越来越多的证据表明星形细胞功能障碍与阿尔茨海默病(AD)有关,AD是一种以进行性认知丧失为特征的神经退行性疾病。淀粉样蛋白-β (a β)斑块的积累是AD的组织病理学标志,并与星形胶质细胞反应性增加有关。在APP/PS1小鼠建立AD模型(9个月)中,我们现在显示星形细胞形态改变,星形细胞半通道活性增强,主要由连接蛋白43 (Cx43)组成。在两种早期AD模型中,海马星形胶质细胞的半通道活性也增加:(1)脑室内(icv)给予Aβ1-42的小鼠,(2)与Aβ1-42肽重叠的海马切片。APP/PS1小鼠海马胶质小体中Cx43水平升高,而给予a - β1-42的小鼠仅显示Cx43磷酸化水平升高。这表明半通道活性可能在AD进展过程中受到差异调节。此外,我们测试了腺苷A2A受体(A2AR)阻断是否逆转了星形胶质细胞半通道活性的改变,并发现A2AR的药物阻断或基因沉默(整体和星形胶质细胞)阻止了海马片中a β诱导的半通道失调,尽管A2AR基因沉默在对照条件下增加了星形胶质半通道的活性。在星形胶质细胞的原代培养中,a2ar相关的保护作用通过蛋白激酶C (PKC)途径发生。我们的研究结果表明,海马星形胶质细胞半通道活性的功能障碍是阿尔茨海默病的早期事件,这是由A2AR调节的。
阿尔茨海默病(AD)是一种神经退行性疾病,其特征是认知功能(即学习和记忆)的进行性下降,这与淀粉样蛋白-β肽(a β)的异常积累有关。尽管a β斑块的存在是AD的主要组织病理学标志,但人们认为可溶性a β低聚物的细胞外积聚是神经变性的诱因,主要是突触退化,突触退化通常与早期AD的特征a β沉积形成之前的记忆障碍的最初迹象有关(见[1])。海马体在阿尔茨海默病的早期阶段尤其受影响,其结构和功能发生改变,典型表现为突触可塑性的改变,而突触可塑性被认为是学习和记忆编码的神经生理基础(见[2])。星形胶质细胞是具有多过程的胶质细胞,主要通过释放ATP和谷氨酸等胶质递质以及从突触间隙摄取谷氨酸和GABA的能力,与60-70%的海马突触建立联系并调节突触可塑性[3,4,5]。因此,越来越多的证据支持星形胶质细胞在阿尔茨海默病发病和进展中的作用,正如阿尔茨海默病小鼠模型(例如APP/PS1)和人类患者中星形胶质细胞的一些形态和分子变化[6,7]以及β斑块形成与星形胶质细胞形态和活性变化之间的联系[8,9]所表明的那样。
星形胶质细胞反应依赖于连接蛋白(Cx)的功能,连接蛋白是形成间隙连接通道和半通道的蛋白质,允许离子和小分子(如IP3、ATP、谷氨酸和能量代谢物)在细胞间流动(见[10,11])。星形胶质细胞半通道主要由Cx43和Cx30六聚体组成,它们在星形胶质细胞过程中积累,释放胶质递质和离子通量,调节海马突触传递和可塑性,从而调节记忆[12,13]。在AD动物模型中,即转基因APP/PS1和5xFAD小鼠中,星形胶质细胞Cx43水平上调[14,15,16]。此外,有证据表明,阿尔茨海默病动物模型中的星形细胞半通道功能失调,但星形细胞的间隙连接通讯并未发生改变[17,18,19]。此外,在8-18月龄的成年APP/PS1小鼠中,有报道称,激活的小胶质细胞不会导致连接蛋白免疫反应性升高,而连接蛋白免疫反应性升高主要集中在浸润淀粉样斑块的星形胶质细胞中[14],这意味着ad相关的连接蛋白半通道改变是星形胶质细胞固有的。
本课课组之前的研究表明,暴露于Aβ肽的培养星形胶质细胞显示出Cx43半通道的增强,而与Cx43密切相关的腺苷A2A受体(A2AR)调节半通道的水平和活性[20]。A2AR调节受Aβ暴露影响的关键星形细胞功能,如谷氨酸摄取[21],ATP释放和半通道活性[20],以及Ca2+信号传导[22],我们最近发现,成年小鼠海马中星形细胞A2AR的遗传缺失会损害突触可塑性并导致记忆缺陷[23]。此外,一些研究支持A2AR是治疗AD的一个有希望的靶点,因为A2AR的药理学或遗传阻断可以提供神经保护[24,25,26,27,28]。同样,与Cx43一样,暴露于脑室内Aβ的小鼠[21]、表达人淀粉样蛋白前体蛋白的小鼠[29]、3xTg-AD小鼠[28]和APP/PS1小鼠[26]以及AD患者[29]的海马中星形细胞A2AR增加。然而,在AD早期Cx43半通道的活性是否被改变,以及A2AR是否调节海马星形胶质细胞半通道的活性,尚不清楚。因此,在本研究中,我们采用早期AD的体内和离体模型来研究海马切片中星形细胞半通道活性的变化,并测试A2AR是否在生理和AD样条件下调节Cx43半通道活性。
动物在受控环境(23±2°C, 50±10%相对湿度,12 h明暗循环)下自由供应食物和水。小鼠的处理遵循“3R”原则,所有实验均经科英布拉大学神经科学与细胞生物学中心伦理委员会(ORBEA_300_2021/24092021)批准,并获得法国食品卫生总局(DGAV;葡萄牙国家动物卫生和福利管理局,0421/000/000/2021)。
采用具有B6C3F1/J遗传背景的双转基因小鼠APPswe/PS1dE9 (APP/PS1)系(Jackson Laboratory, Bar Harbor, Maine,菌株B6;C3-Tg(APPswe,PSEN1dE9)85Dbo/Mmjax RRID:MMRRC_034832-JAX)和野生型(WT)窝代。为了避免发情周期的影响,我们选择了9个月大的雄性小鼠,因为在这个年龄的雄性和雌性小鼠中,参考记忆和突触可塑性的缺陷已经很明显[25,30]。我们还使用了从西班牙巴塞罗那查尔斯河实验室获得的C57Bl/6雄性小鼠(MGI目录号(Cat#) 5811150,研究资源标识符,RRID:MGI:5811150),以及由波士顿大学医学院陈江范生(Jiang-Fan Chen)产生的具有C57Bl/6遗传背景的A2AR基因敲除小鼠(GbA2ARKO)和前脑神经元条件敲除小鼠(FbA2ARKO)。通过Cre-lox方法,在A2AR flox (A2Aflox/flox)小鼠中实现了星形细胞中A2AR的选择性缺失。简单地说,将aav5 - gmap - gfp - Cre病毒构建体(4.8 × 1012颗粒/mL,来自美国北卡罗来纳大学Vector Core)双侧注入海马背侧CA1区(gmap - Cre - a2ar小鼠),而对照组(gmap - ctr)小鼠则接受不含Cre重组酶的类似构建体aav5 - gmap - egfp (Vector Core, University of North Carolina, USA),如上文所述[23]。
一些C57Bl/6小鼠(5只小鼠)接受脑室内(icv)给药合成肽Aβ1-42 (Bachem),如前所述[24,31]。将a β1-42溶解于无菌水中,得到主要由可溶性单体和低分子量低聚物(2.25 mg/mL)组成的溶液,并给予4 μL a β1-42 (2 nmol)或水(对照物)icv,在海马体内转化为5-30 pmol水平的a β1-42[24]。正如我们之前报道的那样,a - β1-42-icv模型概括了早期AD的两个主要特征,即参考记忆和突触功能的损害[24,31]。
Morris水迷宫测试如前所述[32],以评估海马体依赖的空间学习和记忆。试验在直径105厘米的圆形水池中进行,水池中装满了用无毒白色油漆不透明的水。平台被淹没在水面下1cm处。习得训练阶段包括4次游泳训练,每天60秒,每次训练间隔20分钟。在每次试验中,将小鼠从不同的落点放置在水池中,并给予60秒的时间找到隐藏平台的位置。为了完成试验,动物们必须在平台上停留10秒。当4个落点的平均逃避潜伏期达到20 s时,此阶段结束。然后进行保留/探针试验,其中平台被移走,小鼠从随机放置的位置放置在池中,并允许自由游泳60秒。使用Any-Maze 4.99版跟踪软件(Stoelting, Wood Dale, USA, RRID:SCR_014289)记录隐藏站台位置的交叉次数。如前所述,我们离线分析小鼠在保持实验中寻找平台位置的策略,并将其分为海马体依赖型(异体中心)和海马体独立型(自我中心)两类[33]。
小鼠在氟烷深度麻醉后斩首处死。脑切除,海马解剖于低温、氧合(95% O2和5% CO2)人工脑脊液溶液(aCSF,组成:124 mM NaCl、3 mM KCl、1.25 mM NaH2PO4、26 mM NaHCO3、10 mM葡萄糖、1 mM MgSO4和2 mM CaCl2)中;pH值7.4)。用McIlwain组织斩波器获得400 μm厚的海马横向切片,然后在32°C气化ACSF中恢复功能和能量90 min。
对照海马切片(CTR)仅灌注aCSF。对于a β1-42,在检测半通道活性之前,将海马切片与a β1-42 (aCSF中50 nM)重叠60分钟,我们之前已经证明肽暴露的浓度和时间会影响突触可塑性(见[34])。我们之前报道过a - β1-42溶液主要含有可溶性单体和低聚物[21,24]。在测试A2AR的作用时,将A2AR选择性拮抗剂SCH58261,[(2-(2-呋喃基)-7-(2-苯乙基)- 7h -吡唑[4,3-e][1,2,4]三唑[1,5-c]嘧啶-5-胺,50 nM在aCSF, Tocris Bioscience]中孵育30分钟,并在暴露于Aβ1-42期间持续与SCH58261混合。在APP/PS1小鼠实验中,在aCSF中灌注Gap19 (250 μM);在检测半通道活性之前,先检测90分钟。
半通道的活性是用溴化乙啶(EtBr)试验进行的,如前所述[35,36]。简单地说,药物治疗后,海马切片用EtBr (20 μM;Sigma-Aldrich)在含氧室aCSF溶液中室温(RT)浸泡5分钟,然后用带气的aCSF冲洗15分钟以阻止EtBr的吸收。然后将海马切片在4°C下浸泡在4%多聚甲醛(PFA)溶液中(137 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4和1.9 mM KH2PO4, pH 7.4)中过夜,然后用甘氨酸溶液(0.5 M)冲洗5分钟,以阻断产生背景信号的未反应醛。这一步之后用PBS洗了几次。切片在整个过程中都要避光,并进一步处理以进行GFAP免疫标记,如前所述[23]。简单地说,将海马切片用0.1% Triton X-100 PBS渗透30分钟,然后用阻断液(10%马血清,0.1% Triton X-100 PBS)阻断2小时。然后用阻断液稀释一抗兔抗gfap (1:1000, Millipore Cat# AB5804, RRID:AB_2109645),在4℃下孵育2天。清洗后,切片先用阻断液孵育30分钟,然后用驴抗兔488 (1:1000,Thermo Fisher Scientific Cat# a -21206, RRID:AB_2535792)二抗rt孵育4小时。对于从gmap - cre - a2ar小鼠获得的海马切片,我们也用山羊抗gfp (1:50 00, Abcam Cat# ab6673, RRID:AB_305643)和山羊抗488 (1:1000,Molecular Probes Cat# a -11055, RRID:AB_2534102)和兔抗647 (1:1000,AB_2535792)作为一抗。分子探针Cat# A-21245, RRID:AB_141775)作为二抗。然后用PBS在10分钟内清洗3次海马切片,用Hoechst33258 (1:2000, Sigma Aldrich)在RT下孵育30分钟,用PBS在10分钟内再次清洗3次,并用Fluoromount Aqueous mount Medium (Sigma-Aldrich)处理过的Ibidi μ-slide 8上。使用LSM 710共聚焦倒置显微镜(蔡司,RRID:SCR_018063), 40倍物镜(Plan-Apochromat 40×/1.4 Oil DIC M27物镜)观察海马切片,使用Black Zen软件(RRID:SCR_018163)获取z堆叠。
对星形胶质细胞内EtBr荧光信号的分析,采用惠更斯软件(RRID:SCR_014237)对共聚焦显微镜获得的图像进行反卷积处理,减少失焦信息,从而通过经典的最大似然估计(CMLE)算法提高空间分辨率。然后,在GFAP通道中进行归一化操作,以便使用Imaris软件(RRID:SCR_007370)改善GFAP+细胞的可视化,该软件用于随后的处理阶段和分析。下一步是通过在细胞核通道中创建表面进行细胞核分割。星形胶质细胞核是根据以下标准人工选择的:(i) GFAP阳性的细胞,包含一个被GFAP免疫标记结构包裹的单个细胞核,(ii)细胞核未被截断,(iii)细胞核在背景上方显示EtBr荧光。在分析GFP - cre - a2ar小鼠海马切片时,考虑了另一个标准:仅评估GFP免疫标记的GFP阳性细胞。EtBr摄取量化为每个星形胶质细胞(即GFAP+细胞)的EtBr荧光强度(任意单位,au)与核体积(μm3)之间的比值;然后,我们计算,在每个实验条件下,将EtBr摄取的平均值归一化(比率)到相应的控制条件。应该提到的是,所有GFAP+细胞都占用EtBr,我们检查了不同实验条件下星形胶质细胞核体积的差异,没有发现统计学上显著的差异(数据未显示)。
APP/PS1和WT小鼠经心灌注冰PBS,然后在PBS中加入4% PFA。取脑,在PFA中固定24小时,在30%蔗糖溶液中脱水72小时,在- 80°C冷冻保存。使用低温恒温器(CryoStar NX50, ThermoScientific, RRIDD:SCR_022732)获得冠状脑切片(30 μm),按照先前描述的方案进行a β免疫标记和硫黄素- s染色,并进行轻微修改[37]。首先,将风干切片放入柠檬酸缓冲液(10 mM柠檬酸钠三碱脱水,0.05% Tween 20, pH 6.0)中95℃孵育15分钟,进行抗原提取。然后,用PBS冲洗3次,孵育5分钟。用0.2% Tween 20溶液在PBS中渗透15分钟,用1%牛血清白蛋白(BSA) 0.05% Tween 20在PBS中孵育30分钟,阻断非特异性结合。切片在密闭湿度室中与小鼠抗β-淀粉样蛋白(βA)一抗(1:250,Covance Cat# SIG-39320, RRID:AB_662798)在阻断溶液中孵育过夜。切片在PBS中再次洗涤3次,5分钟,然后用二级抗小鼠Alexa594抗体(1:1000,Molecular Probes Cat# A-21203, RRID:AB_141633)孵育2小时。PBS冲洗3次5分钟后,用1%硫黄素-s溶液染色10分钟,用70%乙醇分化,用水冲洗3次,用DAKO贴片培养基贴片并盖上。最后,使用荧光显微镜(蔡司,Axio Imager Z2显微镜,RRID:SCR_018856)观察海马切片,并使用AxioVision成像系统(RRID:SCR_002677版本4.8)捕获图像。
如上所述,分别获得APP/PS1和WT小鼠的自由漂浮冠状脑切片(30 μm厚)。对于GFAP免疫标记,脑切片用PBS冲洗,用渗透溶液(0.1% Triton-X100在PBS中)孵育15分钟,然后用阻断溶液(10%马血清+ 0.1% Triton-X100溶液在PBS中)孵育2小时。之后,切片用兔抗GFAP (1:1000, Millipore Cat# AB5804, RRID:AB_2109645)一抗在4℃孵育过夜。切片用PBS洗涤,再用抗兔Alexa594 (1:1000, Thermo Fisher Scientific Cat# A-21207, RRID:AB_141637)在RT下孵育2小时,再用PBS洗涤。细胞核用DAPI (1:5000, Invitrogen)在室温下染色10分钟。PBS冲洗后,切片用延长?Antifade贴载介质(Cell Signaling Technology)贴载到明胶包被的载玻片上。采用63 ×物镜(Plan-Apochromat 63x/1.40 Oil DIC M27)的LSM 710共聚焦倒置显微镜(Zeiss, RRID:SCR_018063)捕获间隔为0.5 μm的Z-stack图像,用于星形细胞结构的三维重建。
按照先前的描述[23,38,39],使用开放获取工具,Simple Neurite Tracer (SNT, RRID:SCR_016566)插件,对星形胶质细胞结构进行三维重建,研究星形胶质细胞的形态。如上所述,使用Z-stack图像对海马背侧CA1亚区辐射层内的星形细胞过程进行三维重建。根据以下标准选择星形胶质细胞进行星形胶质细胞过程的三维重建:(i)被gmap免疫标记结构包裹的单个细胞核;(ii)星形胶质细胞的主要结构不存在截断的过程;(iii)在两种基因型的每只动物中,在满足上述标准的前5个星形胶质细胞中进行重建。星形细胞乔木复杂性的形态计量学分析是通过量化过程的数量、它们的总长度和以4 μm的间隔从体细胞中心开始的同心圆相交的数量来进行的(Sholl分析)。
如前所述,通过不连续的Percoll梯度从海马组织中获得胶质体[40,41]。简单地说,海马组织在冷冻分离蔗糖溶液(0.25 M蔗糖,10 mM HEPES, pH 7.4, 4°C)中使用玻璃聚四氟乙烯组织研磨机均质。通过离心(1000g, 4°C 5分钟)去除细胞核和碎片,将上清小心地放在由23、10、6和2% v/v Percoll在蔗糖溶液(0.32 M蔗糖,1 mM EDTA, 4°C pH 7.4)中组成的不连续梯度上,通过离心(31000g, 4°C 5分钟)分层,最后2000g关闭离心机制动器,以避免突然停止。胶质小体收集在2%和6% v/v Percoll层之间,而突触小体(纯化突触)收集在23%和10% Percoll层之间的界面。每个馏分用等渗生理溶液(140 mM NaCl, 5 mM KCl, 5 mM NaHCO3, 1.2 mM NaH2PO4, 1 mM MgCl2, 10 mM葡萄糖和10 mM HEPES, pH 7.4(4℃))洗涤,并进一步离心(4℃,3万g, 20 min)。在等渗生理液中再次洗涤微球,并在4℃下离心(22,000g,离心20分钟),丢弃上清,将微球溶解在RIPA裂解缓冲液中,该缓冲液中添加1 mM二硫代三糖醇(Sigma Aldrich), 1 mM苯基甲基磺酰氟(PMSF, Sigma Aldrich), 0.001%蛋白酶抑制剂混合物(CLAP;Sigma Aldrich)和磷酸酶抑制剂鸡尾酒phosphoSTOP(罗氏)。通过Western blot对胶质小体和突触小体进行比较分析,证实了我们的胶质小体制剂在突触周围星形细胞过程中富集了蛋白,如Cx43和谷氨酸转运蛋白(GLT-1和GLAST),如图S1所示,与富含突触素的突触小体制剂相比,成年野生型小鼠的胶质小体制剂不仅在GFAP水平上富集,而且在Cx43、GLT-1和GLAST水平上富集。一种广泛使用的突触标记物。
按照前面的描述进行Western blot[20]。用于在Ser368处定量Cx43和phosh -Cx43的蛋白样品量分别为3μg和30μg;用于定量其他蛋白的蛋白样品量为:GFAP 3μg, GLT-1和GLAST 20μg, synaptophysin 10μg。采用兔抗Cx43抗体(1:800,Sigma- aldrich Cat# C6219, RRID:AB_476857)、抗phospho-Cx43- ser368抗体(1:1000,Cell Signaling Technology Cat# 3511, RRID:AB_2110169)、GLT-1抗体(1:1000 ThermoFisher Scientific PA5-17099 RRID:AB_10978571)、GFAP抗体(1:1000,Abcam Ab416 RRID:AB_304334)、GFAP抗体(1:20 00,Millipore Ab5804 RRID:AB_2109645)或小鼠抗synaptophysin抗体(1:20 00 Sigma S5768, RRID:AB_477523)进行检测。这些一抗在Tris缓冲盐水(137 mM NaCl, 20 mM Tris, pH 7.6)中稀释,其中含有0.1% tbs - 20 (TBS-T)和5%脱脂干乳或3%牛血清白蛋白,在4°C下过夜。TBS-T洗涤后,用IgG二抗孵育膜(抗兔,1:10 000,RRID: AB_228338;抗小鼠1:10 000,RRID:AB_228302,均来自ThermoFisher Scientific),在室温下保存2小时。然后清洗膜,使用增强化学发光底物(ECL;GE Healthcare),并通过成像系统(Chemidoc, RRID:SCR_019037)进行可视化。然后,对膜进行抗α-微管蛋白抗体(1:20 000,Sigma-Aldrich Cat# T6074, RRID:AB_477582)检测以控制蛋白负载。使用Image Lab软件(BioRad, RRID: SCR_014210)对蛋白质条带进行密度分析。Cx43和磷酸化-Cx43的相对密度归一化为α-微管蛋白,并以各自对照条件的百分比表示。
星形胶质细胞原代培养按照先前使用的方案制备[20]。简单地说,从2-5天大的Wistar大鼠大脑皮层获得混合胶质细胞培养物,在星形胶质细胞培养基[DMEM,添加10%胎牛血清,青霉素(100 U/mL),链霉素(100 μg/ mL), HEPES (6 g/L)和碳酸氢钠(0.84 g/L)]中生长,并在5% CO2的湿化培养箱中于37°C保持10-15天,直到达到融合。将混合培养物在轨道振动器中以200转/分的速度机械摇动4小时,去除小胶质细胞,通过轻度胰蛋白酶化程序分离星形胶质细胞,以5 × 104个细胞/盖皮的密度重新接种,并在摄取EtBr之前保持培养2-3天。
基于我们之前的经验[42],我们操纵不同的转导系统来探索参与星形细胞半通道调节的机制,即使用蛋白激酶A (PKA)的cAMP类似物和激活剂8-Br-cAMP(8-溴腺苷-3',5'-环单磷酸,5μM;Tocris),蛋白激酶C (PKC)抑制剂GF109203X(2-[1-(3-二甲氨基丙基)吲哚-3-基]-3-(吲哚-3-基)马来酰亚胺,5μM;PKC激活剂PMA (phorbol 12-肉豆蔻酸酯13-醋酸酯,Ascent Scientific, 10 ng/mL)。所使用的化合物浓度是最高的,但对其目标具有选择性(见[42])。所有药物均在a - β1-42 (1 μM, 24小时)攻毒前30分钟应用于培养的星形胶质细胞,该浓度高于切片中使用的浓度,但我们先前定义为触发新生啮齿动物细胞中星形胶质细胞反应性和功能障碍所需的浓度[20,21,22]。
暴露于这些药物后,如前所述[20],通过EtBr摄取来评估半通道的活性。简单地说,星形胶质细胞在HBSS溶液(137 mM NaCl, 5.4 mM KCl, 0.34 mM Na2HPO4, 0.44 mM KH2PO4, 2.7 mM葡萄糖,1.2 mM CaCl2, pH 7.4)中暴露于EtBr (5 μM) 10分钟,洗涤,用4% PFA溶液固定,细胞核用Hoechst 33,258染色。经过三次冲洗后,用Fluoromount?水性安装介质安装盖片。采用荧光显微镜(Zeiss, Axio Imager Z2显微镜,RRID:SCR_018856与AxioVision成像系统,RRID:SCR_002677版本4.8)从五个随机场采集图像,并使用FIJI-ImageJ软件(RRID:SCR_002285)进行分析。
数据以指定数量(n)的动物(在行为和Western blot分析的情况下)或来自不同动物的海马切片(用于EtBr摄取量化)的平均值±SEM表示。对于星形细胞过程三维重建的数据,n表示重建的细胞数。实验组之间的比较采用双因素方差分析,然后采用Tukey或Sidak多重比较检验。两个实验条件之间的比较使用配对或非配对的学生t检验进行。为了确定莫里斯水迷宫测试中使用的策略之间的差异,我们建立了一个权变表,并进行了Fisher独立性精确检验。WT和APP/PS1小鼠星形细胞形态计量学分析的差异(Sholl分析)采用多重Student's t检验,采用Holm-Sidak方法对多重比较进行校正。p值< 0.05,差异有统计学意义。所有统计检验采用Graphpad Prism软件(版本8.0.1,RRID:SCR_002798)进行。
摘要。
介绍
材料与方法
结果
讨论
数据可用性
参考文献。
致谢。
作者信息
道德声明
# # # # #
Morris水迷宫测试的学习记忆评估结果显示,WT小鼠在整个习得阶段均表现出正常的学习模式,并在第3天达到逃避潜伏期标准(20 s)(第1天:38.43±4.07 s vs.第3天:10.73±1.57 s, n=10);APP/PS1小鼠未达到逃避潜伏期标准(第1天:46.72±2.12 s,第3天:38.94±2.20 s, n=9)。双向方差分析发现基因型是变异的一个来源(F1,17=56.63, p < 0.0001),事后Sidak多重比较检验显示WT和APP/PS1小鼠在第2天(20.15±3.30 s vs. 41.90±4.55 s, p < 0.0001)和第3天(10.73±1.57 s vs. 38.94±2.20 s, p < 0.0001,图1A)差异具有统计学意义。在探针实验中,APP/PS1小鼠在获取阶段24 h后穿越平台位置的次数明显少于WT小鼠(WT: 2.70±0.34,n=10, vs. APP/PS1: 0.56±0.18,n=9, p < 0.0001, t17=5.482,图1B)。因此,APP/PS1小鼠表现出海马依赖性记忆受损。在分析搜索模式时,我们观察到APP/PS1优先采用非海马依赖策略(只有33%的APP/PS1小鼠使用依赖海马的策略),而90%的WT小鼠使用海马依赖策略来寻找隐藏平台的位置(p < 0.0001,图1C)。
图1
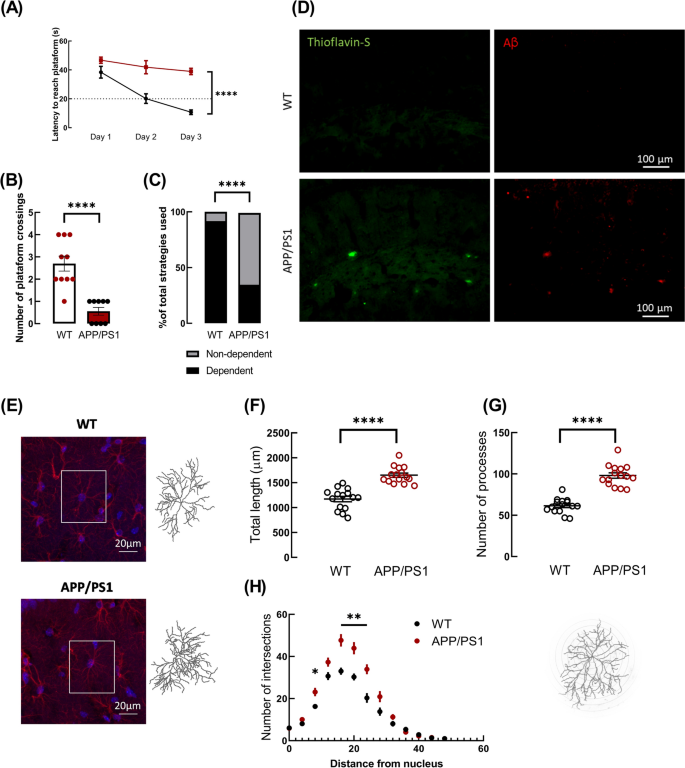
APP/PS1小鼠表现出海马依赖性记忆的缺陷,Aβ和Aβ斑块的积累以及海马星形细胞乔木复杂性的增加。A在Morris水迷宫测试中,APP/PS1小鼠在习得学习曲线中发现隐藏平台位置的潜伏期高于WT小鼠。****p < 0.0001,双向方差分析后进行事后Sidak多重比较检验。Morris水迷宫实验探针实验中,B APP/PS1小鼠由于平台位置的交叉次数明显低于WT小鼠,因此表现出空间记忆障碍。****p < 0.0001,未配对学生t检验。C .对Morris水迷宫探针实验中搜索策略模式的分析发现,WT小鼠优先使用涉及海马的策略,而APP/PS1小鼠大多使用不依赖海马的策略来发现隐藏平台的位置。****p < 0.0001, Fisher独立性确切检验。数据以n=9-10只小鼠的平均值±SEM表示。D巯基黄素- s染色(左列,绿色)和Aβ免疫标记(右列,红色)的代表性图像显示APP/PS1小鼠海马中存在淀粉样蛋白-β斑块,而WT小鼠则没有。标尺:100 μm。E: WT和APP/PS1小鼠的GFAP免疫标记的代表性图像(红色),放大63倍,显示海马星形胶质细胞的形态。细胞核用DAPI染色(蓝色)。标尺:20 μm。图中显示了每组三维重建星形胶质细胞的代表性填充:与WT小鼠的星形胶质细胞相比,APP/PS1小鼠通过F总长、G突数和H - shl分析显示其形态复杂性增加。数据为来自3只不同小鼠的15个星形胶质细胞的平均值±SEM。****p < 0.0001, unpaired Student's t检验,多重t检验的Sholl分析中*p < 0.05, **p < 0.01
接下来,我们检查了APP/PS1小鼠海马中Aβ的积累和沉积。图1D显示了APP/PS1小鼠海马中Aβ的积累,硫黄素- s染色进一步支持这些肽积累的存在,提示存在淀粉样斑块。相比之下,WT小鼠海马未见硫黄素s染色。此外,我们通过对CA1海马区的星形胶质细胞进行三维重建,研究APP/PS1小鼠的星形胶质细胞树突复杂性是否发生改变。APP/PS1小鼠的星形胶质细胞的总突起长度(APP/PS1: 1651.15±43.18μm vs WT: 1171.43±54.27μm, n=15个来自3只小鼠的星形胶质细胞,p < 0.0001, t28=6.917,图1F)和突起数量(APP/PS1: 98.07±3.30 vs WT: 61.47±2.30,n=15个来自3只小鼠的星形胶质细胞,p < 0.0001, t28=9.098,图1G)均显著高于WT小鼠的海马星形胶质细胞。这表明与WT小鼠相比,APP/PS1小鼠海马星形胶质细胞的形态复杂性有所增加。这些结果得到了Sholl分析的支持,该分析揭示了与WT小鼠相比,APP/PS1在距离中央体8μm和16 - 24μm处的星形细胞乔木复杂性显著增加(8μm: p=0.0312, 16μm: p=0.0023, 20μm: p=0.0035和24μm: p=0.0033,图1H)。
使用溴化乙锭(EtBr)摄取法评估海马切片星形细胞半通道的活性。数据显示,基因型对海马星形胶质细胞摄取EtBr有显著影响(p=0.0179, F1,8=8.809),通过事后多重比较检验进一步分析发现,APP/PS1海马星形胶质细胞摄取EtBr比WT小鼠显著增加(WT小鼠1.00±0.036 vs APP/PS1小鼠1.69±0.087,n=5, p=0.0004,图2B)。为了研究Cx43对APP/PS1小鼠半通道活性改变的贡献,我们使用Gap19选择性阻断Cx43半通道[43]。双因素方差分析显示,Gap19的影响显著(p=0.0014, F1,7=26.13), Gap19与基因型之间存在交互作用(p=0.0015, F1,7=25.35)。Sidak多重比较试验显示Gap19对APP/PS1小鼠海马星形胶质细胞摄取EtBr有显著影响(CTR为1.685±0.087,Gap19为1.066±0.163,n=5, p=0.0003)。因此,Cx43半通道是EtBr摄取的主要贡献者,它们的阻断挽救了功能失调的半通道活性,将星形细胞EtBr摄取恢复到与WT相似的水平(图2B)。
图2
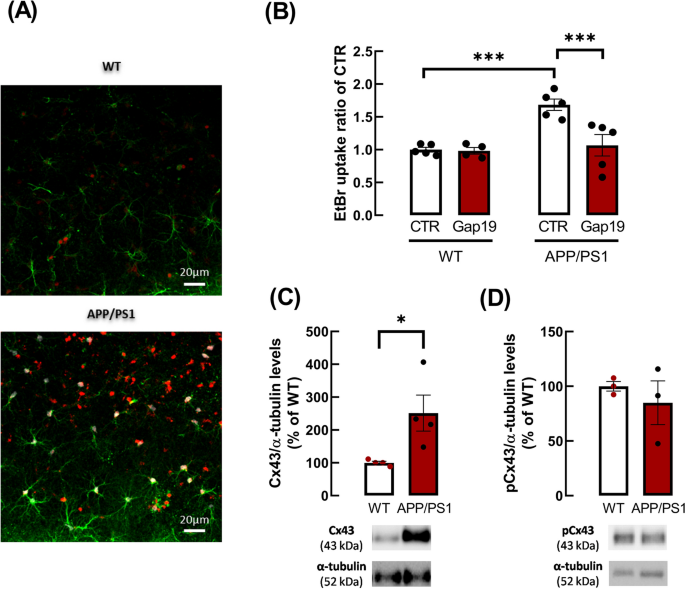
APP/PS1小鼠海马星形胶质细胞中Cx43半通道活性升高,Cx43水平升高。图:WT和APP/PS1小鼠海马切片星形胶质细胞内EtBr荧光信号(红色)的代表性图像。星形胶质细胞用抗gfap免疫标记(绿色),细胞核用Hoechst 33,258染色(蓝色)。比例尺:20 μm。APP/PS1小鼠海马星形胶质细胞对B EtBr的摄取明显高于WT小鼠。选择性阻断Cx43半通道可显著降低APP/PS1小鼠星形胶质细胞对EtBr的摄取,表明这些通道参与了EtBr的摄取。APP/PS1小鼠海马切片用Cx43半通道抑制剂Gap19(250μM, 90 min)处理,然后进行EtBr摄取测定。***p < 0.001,双因素方差分析后进行事后Sidak多重比较检验。通过EtBr信号的荧光强度、WT或APP/PS1小鼠的每星形胶质细胞(GFAP+细胞)核体积(μm3)和对照条件下的比值来评估半通道的活性。数据为5个独立实验的平均值±SEM。C .相对于WT小鼠,APP/PS1海马胶质小体(星形细胞过程的膜)中总Cx43水平升高,但Ser 368位点磷酸化Cx43水平未升高。总Cx43或Ser 368水平磷酸化Cx43与α-微管蛋白的免疫反应性之比以百分率表示。数据为3-4次独立实验的平均值±SEM。*p < 0.05,未配对学生t检验。Cx43、磷酸化Cx43和α-微管蛋白的代表性免疫印迹显示在平均柱状图的下方
考虑到Cx43半通道在APP/PS1小鼠EtBr摄取改变中的相关作用,我们进一步评估了与WT小鼠相比,APP/PS1海马胶质小体(星形细胞过程膜)中Cx43水平的推定改变。数据显示,与WT小鼠相比,APP/PS1小鼠胶质体中Cx43水平显著提高(WT为100.00±4.68%,APP/PS1小鼠为251.33±55.02%,n=4, p=0.0337, t6=2.741,图2D)。由于半通道的活性是由磷酸化调节的,我们还评估了Cx43在Ser368位点磷酸化的改变,在WT和APP/PS1小鼠的胶质小体之间没有观察到改变(WT为100.00±43.85%,APP/PS1为87.95±32.30%,n=4, p=0.8323, t6=0.2212,图2E)。WT小鼠的pCx43与总Cx43的比值为1.00±0.12,APP/PS1小鼠的比值为0.64±0.12,说明总Cx43水平升高。
上述数据表明,成年APP/PS1小鼠在9月龄时表现出海马依赖性记忆缺陷,也表现出与星形细胞形态改变平行的Aβ斑块,海马半通道活性增高,Cx43水平升高。然而,一些证据表明,可溶性Aβ低聚物而不是Aβ沉积物主要导致AD早期的神经元功能障碍、突触丧失和早期记忆缺陷(参见[1,44])以及星形细胞功能障碍[34,35]。因此,我们接下来评估了模拟早期AD条件下的半通道活性,使用直接与Aβ1-42 (50 nM, 60 min)重叠的海马切片和从脑室内注射Aβ1-42 (icv-Aβ1-42)的成年小鼠收集的海马切片,我们之前发现,在肽给药15天后,海马突触可塑性和记忆障碍没有Aβ沉积的证据[24,34]。在暴露于Aβ1-42的海马切片中,星形胶质细胞对EtBr的摄取明显高于对照切片(Aβ1-42组为2.03±0.185,n=5; CTR组为1.00±0.075,n=4, p=0.0475, t3=3.250,图3A)。同样,与对照小鼠相比,icv Aβ1-42也导致海马星形胶质细胞对EtBr的摄取增强(icv- veh: 1.00±0.075,n=4 vs. icv Aβ1-42: 1.42±0.127,n=5, p=0.0323, t7=2.664,图3B)。
图3
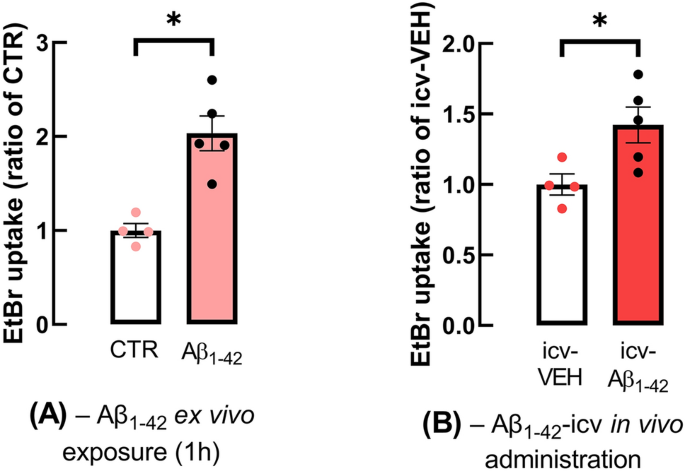
模拟早期AD的星形胶质细胞的半通道活性也增强。与对照(或给药)WT小鼠相比,与Aβ1-42 (icv-Aβ1-42)和Aβ1-42 (icv-Aβ1-42)注射icv的WT小鼠的海马切片星形胶质细胞的半通道活性增强,这是在Aβ1-42或载药icv给药15天后进行的EtBr摄取测定。以每星形胶质细胞核体积内EtBr信号的平均荧光强度评价半通道的活性,并在各实验条件下以对照比表示。数据为4-5次独立实验的平均值±SEM。*p < 0.05, (A)为成对,(B)为不成对
由于在APP/PS1小鼠中,星形细胞半通道活性的增强与Cx43水平的增加有关,我们接下来分析了Aβ1-42-icv给药是否影响海马胶质体中的Cx43水平。奇怪的是,尽管未发现Cx43水平发生变化(WT: 100.00±2.41% vs. a β: 93.29±15.45%,n=5, p=0.6836, t8=0.4227,图4A),但与对照小鼠相比,注射a β1-42-icv后海马胶质体中Ser368残基磷酸化的Cx43水平显著增加(WT: 100.00±6.30% vs. a β: 171.28±16.27%,n=4, p=0.0065, t6=4.085,图4B)。因此,icv-VEH小鼠磷酸化-Cx43(Ser368)/总Cx43的比值为0.98±0.05,icv- a - β1-42小鼠为1.56±0.05。
图4
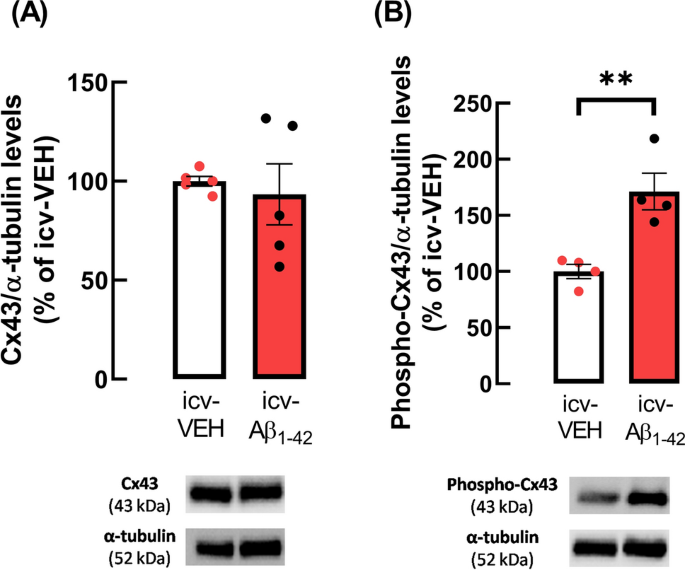
a - β1-42-icv增加了模拟AD早期小鼠海马胶质小体中Cx43第368位丝氨酸磷酸化。虽然没有观察到A -Cx43水平的变化,但与注射了icv-vehicle (VEH)的对照小鼠相比,注射A - β1-42的小鼠海马胶质体中B磷酸化-Cx43水平(Ser368)增强。数据是Cx43或磷酸化Cx43与α-微管蛋白(装载控制蛋白)免疫反应性之间的比率,以对照条件(icv-VEH)的百分比表示。数据为4-5次独立实验的平均值±SEM。**p < 0.01,未配对学生t检验。所示为Cx43、磷酸化Cx43和α-微管蛋白的代表性免疫印迹
接下来,我们研究了星形细胞A2AR是否参与了海马星形细胞半通道活性的调节。为此,我们使用了一种海马中星形细胞A2AR基因沉默的小鼠模型,如上所述(“动物和手术”部分)。数据显示,与对照组小鼠相比,沉默星形细胞A2AR增加了星形细胞对EtBr的摄取(GFAP-CRE-A2AR为1.25±0.044,GFAP-CTR为1.00±0.031,n=4, p=0.0035, t6=4.641,图5A)。此外,我们研究了沉默星形细胞A2AR是否会影响Cx43的总水平和磷酸化水平。数据显示,Cx43 (gmap - cre - a2ar: 147.97±16.06% vs. gmap - ctr: 100.00±1.78% n=5, p=0.0179, t8=2.968,图5B)和磷酸化-Cx43 Ser368 (gmap - cre - a2ar: 140.78±15.70% vs. gmap - ctr: 100.00±1.49% n=7, p=0.0238, t12=2.586,图5C)水平显著升高,两组的磷酸化-Cx43 /Cx43比值相似(gmap - ctr: 1.00±0.09 vs. gmap - cre - a2ar: 0.098±0.12)。这些数据证实,A2AR控制海马星形胶质细胞中由Cx43组成的半通道的活性,增加Cx43的水平和Cx43的磷酸化。
图5
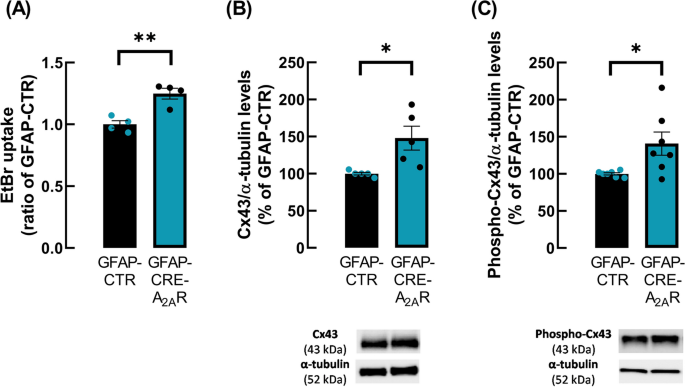
星形胶质细胞A2AR基因沉默增加了海马星形胶质细胞半通道的活性以及Cx43和磷酸化Cx43在Ser368位点的水平。星形胶质细胞中选择性缺失A2AR导致海马星形胶质细胞中EtBr摄取增强。以gmap - ctr和gmap - cre - a2ar小鼠海马切片中每星形胶质细胞核体积表达的EtBr信号的平均荧光强度与对照条件的比值(gmap - ctr)来评价半通道活性。与gap - ctr小鼠相比,gap - cre - a2ar海马胶质小体中B -Cx43和C - phospho-Cx43的Ser368位点水平升高。Cx43和磷酸化Cx43对α-微管蛋白的免疫反应率以gap - ctr的百分比表示。所示为Cx43、磷酸化Cx43和α-微管蛋白的代表性免疫印迹。数据为4-7次独立实验的平均值±SEM。*p < 0.05, **p < 0.01
为了进一步探讨A2AR在a - β1-42肽引发的星形细胞半通道活性失调中的作用,我们采用了不同的方法。首先,采用药理学策略,在a β1-42攻击之前,用A2AR选择性拮抗剂SCH58261体外处理海马切片。双向方差分析显示a - β1-42与SCH58261之间存在相互作用(F1,14=5.241, p=0.0381),事后分析与Tukey多重比较检验显示,A2AR选择性阻断阻止了a - β1-42引发的EtBr摄取增加(a - β1-42: 2.03±0.185,n=5, vs. SCH58261 + a - β1-42: 1.24±0.158,n=5, p=0.0066,图6A,注意a - β1-42/SAL数据与图3A相同)。与对照组相比,施用SCH58261本身对EtBr摄取没有显著影响(SCH: 0.891±0.112 vs CTR SAL: 1.000±0.075;p=0.9604,图6A)。此外,我们进一步采取了A2AR基因沉默。在GbA2ARKO小鼠中,双因素方差分析显示基因型与Aβ1-42之间存在交互作用(p=0.0035, F1.4=38.24), Sidak多重比较检验显示GbA2ARKO小鼠海马片星形胶质细胞摄取EtBr的量显著高于WT小鼠(KO: 1.34±0.087比WT: 1.00±0.088,n=3, p=0.0493)。此外,Aβ1-42的海马切片灌注增强了WT小鼠对EtBr的摄取(Aβ1-42: 1.42±0.109 vs. CTR: 1.00±0.088,n=3, p=0.0023),但不影响GbA2ARKO小鼠海马切片星形胶质细胞对EtBr的摄取(CTR: 1.34±0.087 vs. Aβ1-42: 1.32±0.051,n=3, p=0.9069,图6B)。有趣的是,尽管Cx43水平没有显著差异(WT: 108.65±10.92% vs. KO: 106.26±9.88%,n=6, p=0.8746, t10=0.1619,补充数据图S2A),但在GbA2ARKO小鼠海马胶质小体中观察到Cx43在Ser368位点磷酸化下调(WT: 100.00±9.74 vs. KO: 67.24±3.57,n=4, p=0.0196, t6=3.158,补充数据图S2B)。当在星形胶质细胞中选择性地进行A2AR基因缺失时,双向方差分析显示a β1-42与给予的有效病毒构建物之间存在相互作用(p=0.0183, F1,6=10.34), Sidak多重比较检验显示a β1-42在gap - cre -A2AR小鼠海马片星形胶质细胞摄取EtBr方面缺乏影响(CTR: 1.25±0.040 vs. a β1-42)。(1.28±0.084,n=4, p=0.9320),而在gmap -CTR小鼠中,Aβ1-42显著增加星形胶质细胞摄取EtBr的量(Aβ1-42: 1.38±0.058,n=4 vs. CTR: 1.00±0.031,n=4, p=0.0054,图6C,注意gmap - cre - a2ar和gmap -CTR小鼠的CTR数据与图5A中的数据相同)。相比之下,在FbA2ARKO小鼠中,双向方差分析未显示基因型与Aβ1-42治疗之间的相互作用(p=0.8714, F1,6=0.0286);尽管如此,值得强调的是,在基因型(p=0.0276, F1,6=8.364)和a β1-42处理(p=0.0020, F1,6=27.24)中观察到显著的影响。此外,Sidak多重比较试验显示,a β1-42在WT小鼠(CTR: 1.00±0.031 vs. a β1-42: 1.38±0.058,n=4, p=0.0177)和FbA2ARKO小鼠(CTR: 1.39±0.120 vs. a β1-42: 1.74±0.157,n=4, p=0.0234)中触发的海马星形胶质细胞摄取EtBr显著增强。奇怪的是,与WT小鼠相比,FbA2ARKO小鼠海马星形胶质细胞对EtBr的摄取也显著增加(KO: 1.39±0.120 vs. WT: 1.00±0.031,n=4, p=0.0443,图6D),但a β1-42的超融合同样增加了WT(0.38±0.03)和FbA2ARKO(0.35±0.04)小鼠对EtBr的摄取(p > 0.05)(图6D)。令人惊讶的是,对FbA2ARKO小鼠海马胶质体的分析显示,Cx43水平没有改变(WT: 100.00±2.47%,KO: 102.35±7.58%,n=5, p=0.7760, t8=0.2943,补充数据图S2C), Cx43在Ser368位点的磷酸化也没有改变(WT: 100.00±8.53%,KO: 81.81±16.02%,n=6, p=0.3397, t10=1.003,补充数据图S2D)。综上所述,这些数据确定了星形细胞A2AR在模拟阿尔茨海默病早期病理状态下海马星形细胞半通道活性调节中的重要性。
图6
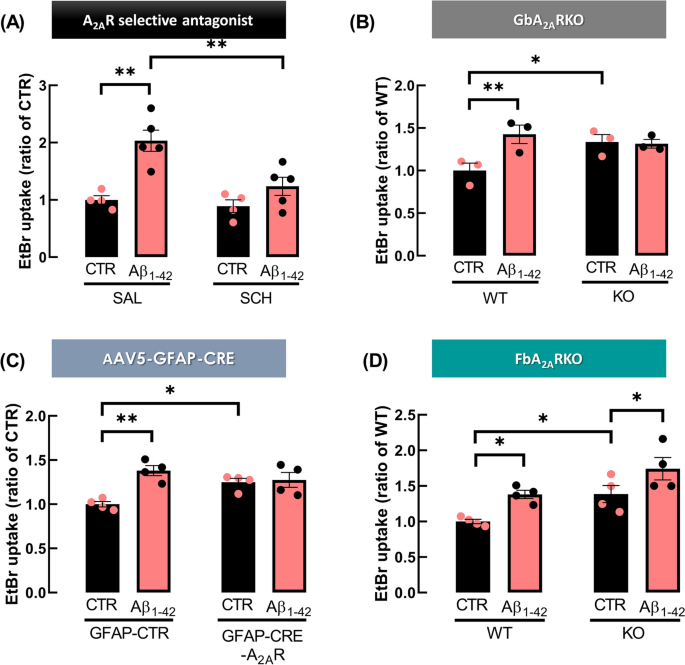
A2AR调节Aβ1-42急性刺激引起的半通道活性改变。A . A2AR选择性阻断可阻止A - β1-42急性暴露海马切片引起的星形细胞半通道活性增强。海马切片用SCH58261 (SCH, 50 nM)预孵育30分钟,然后用Aβ1-42 (50 nM, 60 min)攻毒,然后进行EtBr摄取试验。B在GbA2ARKO和C GFAP-CRE-A2AR小鼠中,Aβ1-42未能增加海马星形胶质细胞对EtBr的摄取,而在FbA2ARKO小鼠中,Aβ1-42增加了星形胶质细胞对EtBr的摄取。通过EtBr信号的荧光强度评估半通道的活性,每个星形胶质细胞(GFAP+细胞)核体积,表示为每只动物的平均值(n),并归一化为对照条件。数据为3-5个独立实验的均数±SEM,对应不同小鼠*p < 0.05, **p < 0.01,采用双向方差分析事后Sidak多重比较检验。请注意,A面板的控制值与图3A相同,C面板的控制值与图5A相同
虽然A2AR是多效受体,但它们主要被认为参与pka介导的转导系统(见[46])。然而,由于我们之前报道过a β1-42诱导的半通道活性增加与PKC磷酸化的Cx43残基Ser368磷酸化增加相平行[47,48],并且这种作用被A2AR激活模仿,并被选择性A2AR阻断[20],我们接下来表征了参与控制培养的海马星形胶质细胞半通道活性的转导系统。我们观察到,用cAMP类似物8-Br-cAMP(5μM)激活PKA不影响EtBr摄取(101.16±9.01% vs. CTR: 100%, t3=0.1284, p=0.9060),而用磷酯类似物(PMA,磷12-肉豆蔻酸13-乙酸酯,10 ng/mL)激活PKC可增加半通道活性(128.10±4.52% vs. CTR: 100%, t3=6.222, p=0.0084,补充数据图S3A)。此外,PMA显著增强了Cx43 Ser368位点的磷酸化(135.1±10.82% vs. CTR: 99.00±6.74%,t6=2.829, p=0.0300,补充数据图S3B)。这些数据表明,a - β1-42触发的半通道活性增强可能涉及pkc介导通路的募集。为了支持这一假设,用GF109203X(5μM)抑制PKC可以阻止Aβ1-42引起的半通道活性增强(图7B)。因此,双向方差分析显示GF109203X (p=0.0002, F1,11=30.14)和a β1-42 (p=0.0031, F1,11=14.16)对培养星形胶质细胞摄取EtBr有显著影响。进一步的Tukey多重比较检验表明,与仅暴露于Aβ1-42的星形胶质细胞相比,GF109203X显著降低了Aβ1-42暴露的星形胶质细胞对EtBr的摄取(87.51±5.36%比138.05±9.14%,p=0.0016)。有趣的是,GF109203X似乎降低了海马星形胶质细胞对EtBr的摄取,但这种作用没有达到统计学意义(71.13±11.39%,p=0.0805)。此外,PMA激活PKC模拟了Aβ1-42对培养星形胶质细胞中EtBr摄取的影响(图7A)。三因素方差分析(F1,31=83.02, p < 0.0001)显示PMA对星形胶质细胞EtBr摄取有显著影响(F1,31=83.02, p < 0.0001), Tukey多重比较检验显示单独a - β1-42刺激的星形胶质细胞EtBr摄取(142.56±3.94%,p=0.0279)、PMA单独刺激(172.58±14.77%,p=0.0008)和PMA + a - β1-42刺激的星形胶质细胞EtBr摄取(165.29±7.42%,p=0.0009)相对于未处理的对照组(100%)显著增加。值得注意的是,PMA与a - β1-42之间没有可加性(p=0.9998)。为了进一步验证PKC介导通路的参与,在a β1-42激活之前,PKC被激活,随后A2AR阻断(图7B)。多重比较试验显示,与对照星形胶质细胞相比,暴露于PKC激活剂PMA和选择性A2AR拮抗剂SCH58261的星形胶质细胞在缺乏(170.64±10.46%,p=0.0001)和存在a β1-42(181.23±21.07%,p < 0.0001)时,EtBr摄取显著增加。此外,从图7B中可以看出,A2AR阻断本身并不影响培养的星形胶质细胞对EtBr的摄取(95.18±3.29%,p > 0.999),但可以阻止Aβ1-42引发的改变(99.95±2.22%,p=0.0409),与我们之前观察到的结果相似[20]。值得注意的是,当星形胶质细胞暴露于PMA、SCH58261和Aβ1-42时,星形胶质细胞摄取EtBr的量显著高于暴露于SCH58261和Aβ1-42的星形胶质细胞(p < 0.0001),但与暴露于PMA和SCH58261的星形胶质细胞相比,预期没有差异(p > 0.05)(图7B)。总之,收集到的结果强烈支持在我们的实验条件下,PKC介导的信号通路的参与,可以招募下游A2AR激活。
图7
暴露于a - β1-42的星形胶质细胞的半通道活性增加受PKC调控。GF109203X (GF)抑制PKC可阻止A - β1-42对星形胶质细胞EtBr摄取的影响。将培养的星形胶质细胞暴露于GF(5μM)中30 min,然后用Aβ1-42(1μM, 24 h)攻噬。数据为3-4个独立实验的平均值±SEM。*p < 0.05,双因素方差分析。B另一方面,PMA (phorbol 12-肉豆蔻酸13-乙酸酯,10 ng/mL)激活PKC模拟了Aβ1-42对星形胶质细胞EtBr摄取的影响。在PMA存在的情况下,选择性A2AR拮抗剂SCH58261 (SCH)不会减弱a β1-42诱导的星形胶质细胞对EtBr摄取的增加。选择性A2AR拮抗剂SCH58261 (SCH)不再能够抑制经PMA预处理的星形胶质细胞中EtBr摄取的增加。将培养的星形胶质细胞暴露于PMA (10 ng/mL, 30 min)中,然后加入SCH (50 nM, 30 min),最后在先前添加的化合物存在的情况下将星形胶质细胞暴露于Aβ1-42(1μM, 24 h),如所示时间轴所示。通过减去背景值后核中保留的EtBr的平均荧光强度来评估半通道的活性。数据以相对于未处理的对照细胞(100%)的百分比值表示,并且是3-5个独立实验的平均值±SEM。*p < 0.05, ***p < 0.001,三因素方差分析
ccDownload: /内容/ pdf / 10.1007 / s00018 - 023 - 04983 - 6. - pdf



