不断增加的基因工程小鼠模型强调了对这些细胞系进行有效存档和分发的需要。精子低温保存因其成本低、时间短、实验动物少等优点,已成为大多数模型的首选技术。然而,目前的体外受精(IVF)方案要么对最流行的C57BL/6菌株表现出较低的受精效率,正如我们最近所证明的那样,要么需要昂贵的培养基和难以制备的培养基。因此,我们先前开发了SEcuRe,这是一种改进的体外受精方案,成本低,受精效率高。该方案中使用的流行基础受精培养基,库克?专有的“体外研究受精”(RVF)最近已停止使用。因此,SEcuRe方法和其他使用这种培养基的体外受精方案的应用受到严重限制。
本研究表明,人类输卵管液(HTF)是一种流行且广泛使用的培养基,其成分已知,可以代替裂谷热作为基础受精培养基。比较58例独立安全试管婴儿中冷冻保存的C57BL/6精子的裂谷热和HTF,发现受精率和活产率相等。此外,我们证明,通过使用超过有效期6个月的商业HTF, HTF的保质期大大延长,但不影响IVF或随后的胚胎发育期间的受精。这一发现不仅提高了改进方法的经济价值,而且再次验证了改进方法的有效性。我们的研究结果表明,普通的、保质期延长的HTF可以用于安全试管婴儿,以取代现已停止使用的裂谷热培养基,并确保该方法的适用性,我们将其称为安全2.0。我们改进的SEcuRe 2.0策略将帮助研究人员有效地存档和分发基因工程小鼠模型,成本效益高,适应性强,符合3r标准,动物使用最少。
在过去的几十年里,基因工程小鼠模型已经成为生物医学研究的主要实验工具。高适应性基因组编辑技术的发展,如CRISPR/Cas9,使得可用的突变小鼠品系数量迅速增加[1]。冷冻保存精子以备将来通过体外受精再分化已成为有效和经济地保存和分配这些菌株的首选方法。与胚胎相比,精子冷冻保存不需要繁殖,需要的动物较少,并且可以在再分化时产生许多胚胎[2]。目前使用的精子冷冻保存和体外受精主要有两种方案:一种是由杰克逊实验室(JAX)的Ostermeier等人开发的,另一种是由动物资源与发展中心(CARD)的Nakagata实验室开发的,通常被称为CARD方案(图1A)[3,4,5,6,7]。
图1
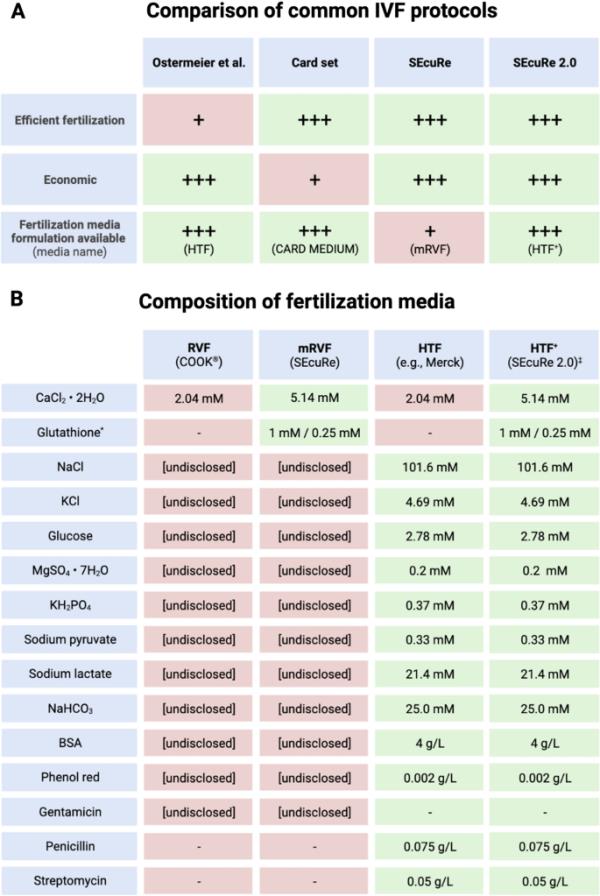
SEcuRe 2.0与已公布的IVF方案的比较。所描述的是SEcuRe 2.0的相关有利(绿色)和不利(红色)特征(A)以及与已发表的IVF方案相比的受精介质组成(B)。*浓度取决于精子来源(冷冻/新鲜收获)。?HTF+的成分与商用CARD MEDIUM?相同[4]
我们最近证明,与Ostermeier等人的方法相比,在体外受精过程中,使用常用的C57BL/6和其他菌株冷冻保存的精子,使用CARD方案的受精率明显更高[8]。尽管有用于卡片协议的商业媒介,预算限制仍然是一个负担。为了使体外受精的常规应用具有成本效益,我们之前发表了我们的体外受精方案,我们将其称为安全(简单经济的再衍生设置),基于CARD的化学性质,在Ostermeier等人的方法范围内成本低,同时保持高受精效率[8]。迄今为止,我们实验室已成功将该方案应用于300多例体外受精,其中包括一项已发表的研究[9],实现了高受精效率和低费用。然而,我们的安全协议在最初的出版物中已经讨论过的一个限制仍然存在:它使用专有介质Cook 's?RVF作为最终受精介质改良RVF (mRVF)的基础(图1A, B)。受精介质是任何试管婴儿方法的关键组成部分。Ostermeier等人的方案使用HTF,这是一种众所周知的小鼠受精培养基,其成分已发表(图1B)[6,7,10]。相反,CARD方案使用CARD MEDIUM?,其发表为HTF,增加Ca2+浓度并添加还原型谷胱甘肽(GSH)以改善受精[4,11,12]。通过用Ca2+和GSH补充商业裂谷热培养基,我们的安全协议直接建立在CARD协议之上。由于流行的裂谷热媒介的制造商在2023年初突然停止生产,因此迫切需要一种替代品。HTF是一种广泛使用且价格低廉的受精培养基,已成功用于小鼠体外受精方案数十年[6,10]。在小鼠体外受精过程中,HTF被认为与裂谷热培养基是可互换的[3,6,13],但据我们所知,这从未被同时评估过。因此,我们试图确定商业HTF是否可以取代专有的RVF来建立一个改进的SEcuRe 2.0协议。凭借原始SEcuRe方法的低成本和简单使用的优势,我们的目标是将其改进为与领先的CARD协议相同的完全可用的介质组合,而无需依赖商业来源的CARD MEDIUM?。(图1)。为了进一步提高我们方法的经济价值,我们还想表明,在指定的过期日期之后,HTF可以很好地使用。
本文中描述的协议是作为原始协议安全方法的更新版本发布的。IO (https://dx.doi.org/10.17504/protocols.io.261ge4j3yv47/v4)[8,14]。
所有动物实验都符合欧洲、国家和机构的指导方针,并得到北莱茵-威斯特伐利亚州办公室、自然、环境和消费者保护部(LANUV NRW,德国;动物研究方案AZ 81-02.04.2019.A335)。小鼠颈椎脱位安乐死。所有的努力都是为了尽可能地减少动物的痛苦。动物饲养在德国科隆大学CECAD研究中心,单独通风笼(Greenline GM500;Tecniplast)在22°C(±2°C)和55%(±5%)的相对湿度下,在12小时的光照循环下,在灭菌的床上(Aspen wood, Abedd, Germany),并可以随意使用灭菌的商业颗粒饲料(Ssniff Spezialdi?ten GmbH)和酸化水。按照欧洲实验动物科学协会联合会(FELASA)的建议对小鼠进行微生物状况检查,小鼠不含所有列出的病原体,包括机会主义者[15]。在稿件准备过程中,遵循ARRIVE指南2.0[16]。
所有培养基均按SEcuRe方法制备[8,14]。HTF+ SEcuRe 2.0受精培养基于体外受精当天制备,在商用EmbryoMax?HTF (MR-070-D,默克公司)中添加1 mM减少的GSH (Sigma;用CaCl2将钙浓度从默认的2.04 mM增加到5.14 mM (Sigma;C7902)类似于前面描述的mRVF施肥介质制备。EmbryoMax?HTF在到达后解冻,分成等份并在- 80°C保存至使用。一旦解冻,等分液在4°C下保存不超过两周。在体外受精当天,从EmbryoMax?HTF中制备HTF+,在制造商截止日期之前或6个月后。精子供体小鼠来源于几种不同的C57BL/6遗传背景突变系[8]。每次试管受精都使用来自同一品系的两个10至20周龄C57BL/6突变雄性的冷冻保存精子。为了提高HTF延长保质期评价条件的可比性,在所有条件下均使用来自同一品系的两只10 - 14周龄雄性精子,均为纯C57BL/6N背景。卵母细胞取自两只3 - 4周龄(即12 - 14g体重)C57BL/6NRj或C57BL/6JRj雌性,取决于精子捐赠者的遗传背景,卵母细胞购自Janvier实验室[8,14],并经过至少5天的驯化。每种情况随机选择2只雌性,以确保有足够数量的卵母细胞,并进行至少3次独立实验,以便进行统计评估。在体外受精24小时后计算受精率,并以达到2细胞期的受精卵总数的百分比表示。为了排除对潜在不育雄性孤雌生殖胚胎的计数,从60个实验的回顾性分析中剔除了两个受精率低于20%的体外受精。胚胎在M16的CO2培养箱(5% CO2,常压O2, 37℃,95%湿度)中体外培养72小时,如果有说明,记录2细胞期胚胎发育的囊胚百分比。按照描述将2细胞期胚胎移植到受者体内,并在预期分娩日期后一天评估每个胚胎移植到受者体内的幼崽数量,以此计算活产率[8]。
Prism 9 (GraphPad;版本9.51)用于创建图形和计算统计显著性,以及描述性统计。对所有数据进行正态性检验(Shapiro-Wilk检验)。采用非配对普通单因素方差分析和Tukey事后检验来评估≥3个数据集(参数)显示高斯分布的数据的统计学显著性。此外,进行了unpaired Kruskal-Wallis with Dunn’s post - hoc检验和Brown-Forsythe and Welch ANOVA with Dunnett’s post - hoc检验,以支持未能拒绝等均值原假设,表明试管婴儿在测试条件下表现同样良好。非高斯分布(非参数)的两个数据集的比较采用非配对双尾Mann-Whitney检验。此外,还进行了未配对的双尾Student t检验、Welch t检验和Kolmogorov-Smirnov检验,以支持未能拒绝等中位数的零假设,以表明协议的表现同样良好。p值小于0.05,认为结果的差异有显著性差异。在整个实验和数据分析过程中,各组分配均未采用盲法。本研究没有排除任何数据和动物,除了在IVF后2细胞期胚胎发育到囊胚后的一次重复数据,由于人为错误而丢失,以及回顾性分析中由于受精率< 20%而丢失的两次IVF数据。通过汇集男性和随机选择女性来最小化联合创始人。本研究的主要数据见附加文件1:C。
摘要
介绍
材料与方法
结果与讨论
限制
数据和材料的可用性
缩写
参考文献
致谢
作者信息
道德声明
补充信息
搜索
导航
#####
制造商已经停止了我们发布的安全协议中使用的基础施肥介质,迫切需要更换。我们首先将以前使用的商用裂谷热培养基与广泛使用的商用HTF (EmbryoMax?,默克公司)交换。最终的受精培养基是通过在RVF或HTF中添加Ca2+和GSH来制备的,分别得到传统SEcuRe的mRVF或新型SEcuRe 2.0的HTF+(图1AB)。我们将后一种施肥介质命名为HTF+,以反映在标准HTF基础上添加的成分。因此,HTF+是一种廉价且易于制备的施肥培养基,其化学成分与CARD medium?相同[4]。我们还试图延长HTF的保质期,因为与销售的大容器相比,试管婴儿所需的数量很少,因此丢弃过期培养基是很常见的。因此,我们从过期至少6个月的商用HTF介质(HTF 6 m过期)中制备HTF+,并将其用于我们的SEcuRe 2.0协议中。
为了验证我们的方法,我们回顾性分析了C57BL/6卵母细胞与基因工程男性冷冻精子在标准mRVF受精培养基(SEcuRe)和新型HTF+受精培养基(SEcuRe 2.0)中的体外受精率。我们考虑了用标准mRVF进行的31个独立实验的结果,发现在总共1406个受精卵中,有1065个发育到2细胞阶段,受精率中位数为84.4%(图2A左小提琴图)。引人注目的是,在27个独立实验中,使用新型HTF+的体外受精导致1998个受精卵细胞中有1485个2细胞胚胎发育,几乎相同的中位受精率为82.5%(图2A右小提琴图)。我们进行了各种统计假设检验,包括最合适的曼-惠特尼检验,以彻底检查我们两种情况之间的差异。所有这些试验的选择都没有偏差,表明两种条件的中位数没有显著差异(附加文件1:B)。为了确认HTF+在体内产生的胚胎的发育能力,我们比较了两种受精培养基产生的2细胞胚胎移植后的出生率。正如预期的那样,我们发现mRVF和HTF+产生的胚胎的平均出生率没有统计学上的显著差异(分别为28%±9%和31%±6%);附加文件1:A)这些发现证明,HTF可用于替代中断的裂谷热,而不会降低受精效率和活产率。
图2
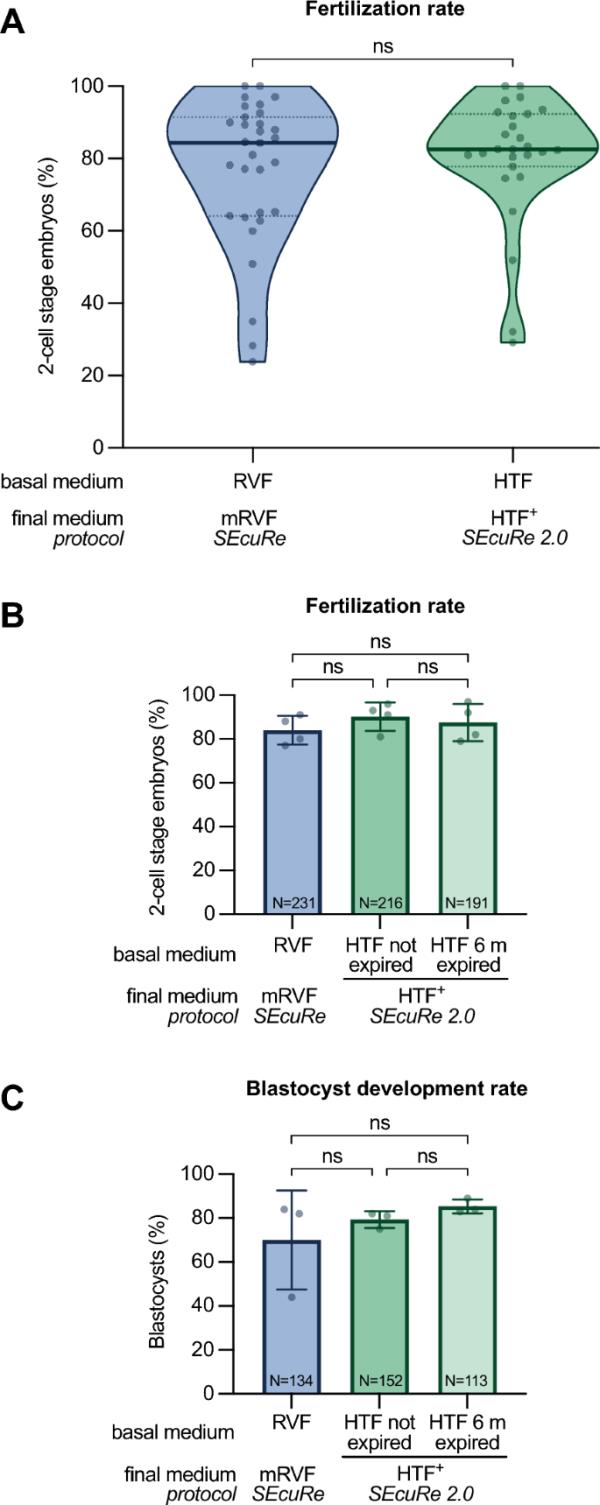
HTF在SEcuRe 2.0中作为基础施肥介质的验证。RVF (SEcuRe)和HTF (SEcuRe 2.0)作为基础施肥介质中位受精率的比较。每个点代表使用来自单个突变C57BL/6系的冷冻保存精子进行试管受精。描述了施肥介质和基础施肥介质。B与未过期HTF或RVF作为基础施肥介质相比,延长保质期HTF的受精率。描述了施肥介质和基础施肥介质。体外受精使用SEcuRe,使用C57BL/6N系冷冻保存的精子。通过评估24 h后2细胞期胚胎的百分比(n=4),从四个独立的实验中显示受精率的量化。C通过对体外培养72 h后达到囊胚期的2细胞期胚胎(n=3)进行量化,评价3个独立实验中胚胎的囊胚发育率。小提琴图中的粗线表示受精率中值,虚线表示第一和第三个四分位数。ns=non-显著(Mann-Whitney检验)。条形图中的圆点表示每个实验的受精率,条形图表示所有实验的平均值±标准差。N表示卵母细胞总数(受精率)或2细胞期胚胎总数(囊胚发育率),ns=无统计学意义[普通单因素方差分析(A)和Mann-Whitney检验(B)]
我们进一步旨在通过防止在许多试管婴儿实验室普遍存在的过期HTF的过早处理来提高方法的经济价值。为此,我们比较了纯C57BL/6N背景下,使用标准mRVF受精培养基(SEcuRe)或未过期或6 m过期HTF培养基制备的HTF+受精培养基(SEcuRe 2.0),卵母细胞与小鼠冷冻精子的体外受精率(图2B)。值得注意的是,我们在4个独立试验中发现,使用6个月过期的HTF制备HTF+(87%±8.4%;图2B右列)与两者相比,未过期HTF制备的HTF+(90%±6.5%;图2B中柱)或mRVF(84%±6.6%;图2B左栏)。这表明HTF的保质期大大延长,最终将进一步降低试管婴儿实验室使用我们的SEcuRe 2.0方法的成本。在三个独立的实验中,我们共对399个胚胎进行了发育,直到囊胚期,我们发现HTF+受精的胚胎的平均发育能力与过期HTF(85%±3.2%;图2C右列)或未过期HTF(79%±3.8%;图2C中柱)或mRVF(70%±22.5%;图2C左栏)。这进一步证明了RVF和http的互换性,并再次验证了我们的SEcuRe 2.0协议。为了支持我们的发现,我们再次采用了各种无偏选择的统计假设检验,包括最合适的单因素方差分析和Tukey事后检验,这表明在三种情况下,受精方式和囊胚发育率没有显著差异(附加文件1:B).总之,这些发现表明,SEcuRe 2.0中广泛使用的HTF可以延长保质期,替代SEcuRe中使用的停止使用的裂谷热培养基。因此,我们改变了协议安全方法的在线版本。io到SEcuRe 2.0以反映对最初发布的方法所做的任何修改[8,14]。
本研究中发现的裂谷热和HTF培养基的冗余功能与已发表的试管婴儿方案一致。例如,Robert Taft (JAX)建议在其流行且非常强大的试管婴儿方案中使用裂谷热或HTF,该方案已成功用于各种不同遗传背景[5,6,7,13]。在此背景下,我们的研究首次提供了必要的实验证据,证明了使用该培养基的IVF方案中流行但已停用的裂谷热和HTF的普遍互换性。此外,平均受精率和囊胚发育率与SEcuRe方法最初发表的结果相当[8]。这再次验证了当前的发现,并证明了我们的安全协议的可重复性。本研究中超过2000个胚胎的30多个独立体外受精程序的结果进一步证明了我们的新SEcuRe 2.0方法的稳健性。总之,我们已经证明了延长保质期的适用性,广泛使用HTF作为停止使用的裂谷热培养基的替代品,为研究人员提供了我们改进的SEcuRe 2.0方案,这是一种具有成本效益和易于适应的体外受精方法,具有最流行的CARD方案的化学性质,可以从冷冻保存的精子中获得3R有利的小鼠模型再分化。
除常用的C57BL/6外,我们还没有确定SEcuRe 2.0的受精效率。我们相信我们的SEcuRe 2.0方法与广泛使用的CARD协议一样健壮,因为HTF+具有与CARD MEDIUM?相同的组成[4]。此外,为了根据3r减少研究中使用的动物,我们决定在目前的研究中仅将少量胚胎移植给体内受体[17,18]。然而,我们之前观察到,不同体外受精方案产生的胚胎在受精后的发育能力没有差异。此外,在目前的研究中,我们只选择了一种通常推荐的商业HTF[3,6],但希望任何用于小鼠体外受精的高质量HTF都能在我们的SEcuRe 2.0协议中使用,因为它们的成分相同。HTF是由几家公司提供的,因此这种媒介的停止以及由此导致的我们战略的不适用在未来是极不可能的。最终,也可以在内部制备HTF,尽管这具有挑战性,因此我们建议使用商业HTF。
附加的统计分析和原始数据。
下载原文档:https://link.springer.com/content/pdf/10.1186/s13104-023-06452-6.pdf