血糖控制不佳的糖尿病患者即使尝试严格控制血糖,视网膜病变也无法停止,提示存在“代谢记忆”现象,实验模型表明,线粒体继续受损/功能失调,进入自由基的恶性循环。我们的目的是研究受损线粒体的去除在代谢记忆中的作用。使用人视网膜内皮细胞(HRECs),在20 mM d -葡萄糖中孵育4天,然后在5 mM d -葡萄糖中孵育4天,评估线粒体周转、线粒体自噬体的形成和线粒体自噬通量。在大鼠代谢记忆模型中证实了线粒体自噬,在诱导链脲霉素诱导的糖尿病后,大鼠保持血糖控制不良(血糖~ 400 mg/dl) 3个月,然后再保持3个月的良好控制(BG < 150 mg/dl)。正常葡萄糖逆转高糖对线粒体周转和线粒体自噬体形成没有影响,线粒体自噬通量仍然受到损害。同样,3个月血糖控制良好的大鼠,在3个月血糖控制不佳之后,对线粒体自噬通量没有影响。因此,在血糖控制不佳时启动的受损线粒体的不良更新/清除,并不能从高血糖损伤的终止中获益,受损的线粒体继续产生自由基,提示线粒体自噬在与糖尿病视网膜病变持续进展相关的代谢记忆现象中的重要性。
视网膜病变仍然是糖尿病最可怕的并发症之一,尽管在该领域取得了许多技术进步,但其发病机制仍然知之甚少。高血糖被认为是糖尿病视网膜病变发展的主要诱因,但具有里程碑意义的糖尿病控制和并发症试验(DCCT)和后续糖尿病干预和并发症流行病学(EDIC)研究清楚地表明,高血糖的终止并不能阻止其进展,糖尿病患者即使在维持良好的血糖控制后,视网膜病变仍在继续发展。此外,如果在糖尿病的早期阶段就开始强化血糖控制,良好的血糖控制的益处将持续超过其机构,提示“代谢记忆”现象[1,2,3]。这种代谢记忆现象在糖尿病视网膜病变的实验模型中被成功复制,包括在培养和化学诱导的糖尿病大鼠或狗的分离视网膜细胞中[4,5,6,7]。然而,去除高血糖损伤后视网膜病变未能停止进展的分子机制仍然不清楚。
糖尿病患者活性氧(Reactive oxygen species, ROS)增加,氧化应激被认为在糖尿病视网膜病变等微血管并发症的发病机制中起重要作用[8]。作为自由基的主要细胞来源,线粒体在糖尿病中受损,视网膜线粒体的结构、功能和基因组稳定性受损[9,10]。线粒体经历不断的裂变和融合,这些动态特性对它们在能量产生中的最佳功能至关重要。融合通过整合两个线粒体的内容物来稀释受损线粒体的内容物,而裂变则分离受损的线粒体成分。这些质量控制机制的失效将导致线粒体终末损伤,从而威胁细胞的生存[11]。线粒体动力学的破坏,除了对线粒体功能产生负面影响外,还会导致线粒体功能失调和受损的积累[12]。在糖尿病视网膜病变中,线粒体动态失衡,mtDNA受损,线粒体生物发生受到抑制,mtDNA拷贝数减少[10,13,14]。此外,实验模型(体外和体内)表明,正常血糖逆转高血糖对线粒体结构、功能和基因组稳定性没有任何好处;线粒体仍然碎片化,受损的线粒体继续进入自由基的恶性循环[6,7,15]。
受损/功能失调的线粒体可以通过泛素-蛋白酶体系统(消除线粒体外膜蛋白)或自噬-溶酶体途径(“线粒体自噬”)降解。线粒体自噬通过特定的自噬途径选择性地排除受损的线粒体作为整个细胞器,其中受损的线粒体被吞噬在双膜胞内细胞器中-“线粒体自噬体”用于溶酶体降解[16,17,18]。线粒体自噬在糖尿病视网膜病变持续发展中的作用尚不清楚。
本研究的目的是研究线粒体转换的作用,以及受损线粒体的去除,在代谢记忆现象中。利用体外模型(人视网膜内皮细胞,HRECs)对代谢记忆、线粒体周转、自噬体形成和自噬通量进行了评估。我们之前的研究表明,在糖尿病视网膜病变的发病机制中,视网膜胞质基质金属蛋白酶(MMPs)的激活会损害线粒体[19];观察抑制MMP-9激活对损伤线粒体去除的影响。在代谢记忆大鼠模型中证实了终止高血糖对线粒体自噬的影响。
从非糖尿病人视网膜中分离的视网膜内皮细胞(HRECs, Cell system, Kirkland, WA),在5 mM d -葡萄糖(NG)或20 mM d -葡萄糖(HG)中,在含有1%胎牛血清、9%血清和1μg/mL内皮生长补充剂的DMEM中培养6至8代,培养4天。高糖暴露的细胞在不存在或不存在4 nM MMP-9抑制剂1的情况下持续处于高糖状态8天[20]。中科院1177749-58-4;Sigma-Aldrich, St. Louis, MO, HG和HG/Inh组),或在5 mM d -葡萄糖中培养4天后,在不添加或添加MMP-9抑制剂的培养基中再培养4天(分别为HG- ng和HG- ng /Inh组)。作为渗透/代谢控制,每个实验都有平行培养,其中HRECs在20 mM l -葡萄糖(L-G)中培养,而不是在20 mM d -葡萄糖中培养[15,21]。
雄性Wistar大鼠(~ 200 g BW),用链脲佐菌素(55 mg/kg体重)致糖尿病,并保持血糖控制不良(血糖> 400 mg/dL;PC组)或血糖控制良好(血糖> 150mg /dL;GC组)6个月。一组大鼠血糖控制不良3个月,随后血糖控制良好3个月(PC-GC)。以年龄匹配的正常大鼠为对照。PC组大鼠注射1 ~ 2 IU胰岛素,每周4 ~ 5次;GC组大鼠注射胰岛素,每天2次,共5 ~ 7 IU。每周给大鼠称重两次;他们的血糖每周测量一次;这些方法在我们的实验室常规使用[15,21]。
线粒体更替是用MitoTimer测定的,该检测基于pMitoTimer的加入原理,荧光计时器报告基因(dsred1 - e5报告基因)在新合成的线粒体中发出绿色荧光,但随着时间的推移不可逆地转变为红色光谱[22]。pMitoTimer质粒,在刺培养中转化细菌获得。不。52659;Addgene, Watertown, MA),在添加了50 μg/ml卡那霉素(Sigma-Aldrich)的LB-agar (MP Biomedicals, Irvine, CA)板上划线。37℃孵育过夜,次日取菌落,用5 ml LB培养基(加卡那霉素,50 μg/ml) 37℃孵育过夜。质粒DNA采用GenElute Plasmid Miniprep Kit (Cat。不。PLN70, Sigma-Aldrich),根据制造商的说明。将第5 ~ 7代的细胞用Opti-MEM转染培养基(Cat。编号31,985,062,Thermo Fisher Scientific, Waltham, MA),并在转染试剂(lipofectamine 3000 with P3000 reagent, Cat)中与含有500 ng pMitoTimer质粒DNA的转染复合物孵育。不。L3000008;赛默飞世尔科学公司)在37°C下放置8小时。然后用DMEM (2 ×)洗涤细胞,加入0.5μg/ml强力霉素诱导MitoTimer表达。孵育4小时后,按实验条件孵育细胞,并在蔡司apoome (Carles Zeiss, Inc., Chicago, IL)下使用20倍物镜在550 nm激发和620 nm波长下成像。利用蔡司软件模块计算红、绿通道荧光强度之比[23]。作为阳性对照,每次实验中也加入25μM氯喹孵育的细胞[24]。
通过自噬检测试剂盒(cat)评估活细胞中自噬液泡的形成。不。ab139484;Abcam, Cambridge, MA),使用阳离子两亲性示踪剂(CAT)染料。简单地说,在实验孵育结束时,用实验缓冲液洗涤细胞,用绿色检测试剂在室温下暗色孵育30分钟。然后使用含有dapi(蓝色)的Vectashield贴载培养基(Vector Laboratories)对细胞核进行反染,并在蔡司apoome 20倍物镜下成像。使用蔡司软件模块确定平均强度。每次实验均加入雷帕霉素(1μM)作为自噬诱导剂对照[25]。
自噬液泡的形成也通过使用与成像相同的自噬检测试剂盒在微孔板阅读器上定量荧光来证实。将细胞与检测试剂在37℃下孵育30 min,用检测缓冲液洗涤去除多余的染料后,加入100 μl检测缓冲液,在480 nm激发波长和530 nm发射波长下测量荧光[26]。计算相对荧光强度(任意单位),考虑正常葡萄糖中HRECs的值为100%。
通过将线粒体与溶酶体共定位来估计线粒体自噬体的形成,这种技术利用了溶酶体降解与受损线粒体结合的自噬体的优势[27]。LysoTraker (LTR,红色)是一种嗜酸荧光探针,用于标记和跟踪活细胞中的酸性细胞器[28],用于标记溶酶体,MiroTraker (MTR)用于标记线粒体。简单地说,实验孵育后,HRECs在37°C下用100 nM LTR (Cat. 10)孵育30 min。不。L7528, Thermo Fisher Scientific)和200 nM MTR (Cat。不。M7514, Thermo Fisher Scientific)。盖片用PBS洗涤,在蔡司apoome镜下20倍物镜下成像[27]。每组取6 ~ 8个细胞,分别对3种不同的细胞制剂进行成像。利用蔡司软件模块对LTR和MTR的强度进行量化,绘制LTR和MTR之间的Pearson相关系数。
使用有丝分裂检测试剂盒(Cat。不。MD0110;Dojindo Molecular Technologies, Rockville, MD)。实验孵育后,用DMEM洗涤HRECs,用100 nM的Mtphagy Dye和1μM的Lyso Dye在37℃下孵育30 min。然后用PBS(2倍)洗涤细胞,并用20倍物镜在蔡司apoome下成像[29]。细胞在25 mM羰基氰间氯苯腙(CCCP)中培养;猫不,C2759;Sigma-Aldrich)作为阳性对照。
在大鼠视网膜中,使用MitoTracker深红色(Cat No. 5)流式细胞术进行线粒体自噬。科学通报(英文版)[30]。简单地说,将新鲜分离的视网膜切成小块,用50μl的Accumax?(Cat No.;A7089, Sigma-Aldrich)在37°C下加热10分钟。消化后的视网膜组织用含有10%胎牛血清的DMEM洗涤,并通过40 μm细胞滤网过滤[31]。细胞用100 nM MitoTracker深红色在37℃下孵育30分钟,用流动缓冲液(0.5% BSA in PBS)洗涤细胞3倍后,在BD Accuri C6 +流式细胞仪(BD Biosciences, San Jose, CA, USA)的FL3 640 nM波长下进行扫描。流式细胞术原始标准文件采用FlowJo v10.8.1软件进行分析。
采用GraphPad Prism (GraphPad Software, San Diego, CA, USA)进行统计分析,方差显著性采用单因素方差分析;P值< 0.05为差异有统计学意义。
摘要
介绍
方法
结果
讨论
数据可用性
参考文献
致谢
作者信息
道德声明
搜索
导航
#####
线粒体在高血糖环境下受到损伤,其生物发生和动力学受到损害[10,14];采用MitoTimer荧光探针测定高糖损伤对线粒体更新的影响。与正常葡萄糖相比,高葡萄糖状态下的细胞绿色荧光向红色转移,红绿荧光的比例明显更高,表明受损线粒体的积累增加。由于MMP-9在糖尿病线粒体损伤中起主要作用[19],因此我们确定了抑制MMP-9对线粒体周转的影响。在高糖培养基中添加MMP-9特异性抑制剂(HG/Inh组)可改善线粒体更新,与单独高糖处理的细胞相比,红绿荧光强度比显著降低。去除高糖损伤不能保护线粒体免受葡萄糖诱导的损伤[6,7],我们确定了正常葡萄糖逆转高糖对线粒体更新的影响。4天高糖(HG- ng组)后的4天正常葡萄糖对线粒体周转没有影响,HG组和HG- ng组的红绿荧光信号比相似,表明即使终止高糖损伤,受损的线粒体仍在继续积累。然而,在高糖暴露后4天的正常葡萄糖(HG- ng /Inh组)中添加MMP-9抑制剂可改善线粒体更新,其值与HG和HG- ng组相比有显著差异(p < 0.05)。20 mM l -葡萄糖中的细胞与5 mM d-葡萄糖中的细胞具有相似的红绿荧光比(图1a和b)。
图1
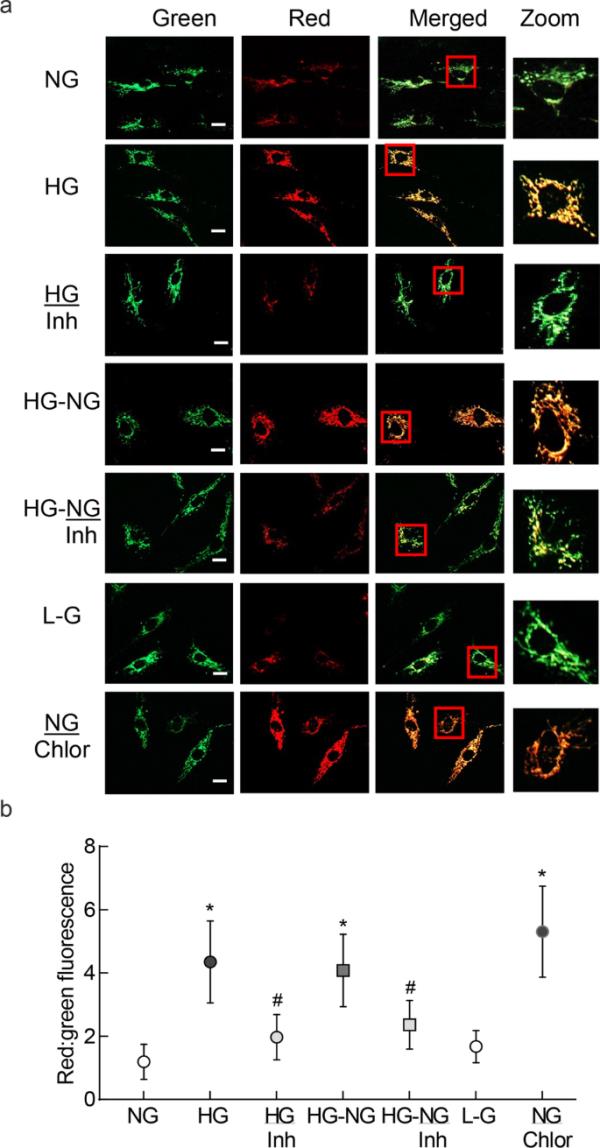
高糖逆转对视网膜内皮细胞线粒体更新的影响。用MitoTimer转染HRECs,并用强力霉素诱导其表达,测定线粒体周转。a使用20 ×物镜(比例尺=20μm)在蔡司apoome中对细胞进行成像。b绘制红色和绿色荧光的比值。数据以三种细胞制剂和5-6个细胞/制剂成像所得值的平均值±SD表示。NG=5 mM d -葡萄糖;HG和HG/Inh=20 mM d -葡萄糖,不含或含MMP-9抑制剂;HG-NG和HG-NG/Inh=4天20mm D-葡萄糖,随后4天5mm D-葡萄糖,不加或加MMP-9抑制剂;L-G=20 mM l -葡萄糖;NG/氯=5 mM d -葡萄糖+氯喹。与NG或HG比较,*和# p分别< 0.05
受损的线粒体被自噬体吞噬以进行溶酶体降解[17];研究了高糖对自噬体形成的影响。与线粒体更新一致,与正常葡萄糖相比,高葡萄糖减少了荧光自噬空泡的数量,自噬染色减少(图2a和b), MMP-9抑制剂阻止了自噬小体形成的减少(与NG相比p > 0.05)。终止高糖损伤,除了阻止线粒体周转减少外,也未能阻止自噬体的减少。然而,在高糖后补充正常葡萄糖,用MMP-9抑制剂(HG- ng /Inh组),可以防止自噬体形成的减少,HG- ng /Inh组的数值与HG或HG- ng组有显著差异。l -葡萄糖(20 mM)对自噬体的数量没有影响(图2a和b)。与免疫荧光结果一致,定量分析也显示,与正常葡萄糖相比,高糖组的相对荧光强度显著降低。连续4天高糖(HG-NG组)后,连续4天正常葡萄糖对自噬体形成无明显影响;HG组和HG- ng组间差异无统计学意义。然而,在正常葡萄糖孵育期间添加MMP-9抑制剂(HG-NG/Inh组)改善了自噬体形成的减少,NG、HG/Inh和HG-NG/Inh的值彼此之间没有差异(p > 0.05;图2 c)。
图2
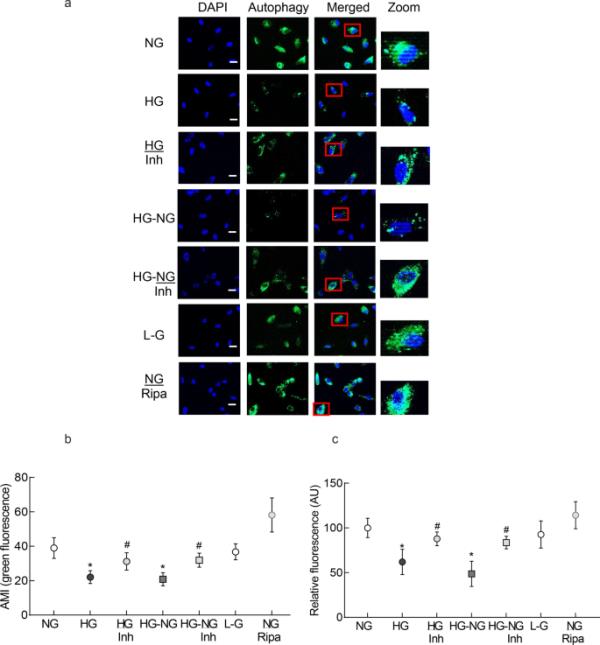
自噬体的形成和高糖损伤的逆转。在活细胞中使用阳离子两亲性示踪剂选择性标记自噬液泡来定量自噬体。a将细胞置于含有dapi(蓝色)Vectashield的安装介质中,在蔡司apoome显微镜下以20 ×物镜(比尺=20μm)成像。b绘制绿色荧光的平均强度。从3到4个细胞制剂中获得的值为平均值±SD,在6个或更多细胞/制剂中进行测量。c在480 nm激发和530 nm发射波长下任意单位(AU)的相对荧光强度图,考虑正常葡萄糖的值为100%。NG和HG=5 mM和20 mM d -葡萄糖;HG/Inh=20 mM d -葡萄糖或MMP-9抑制剂;HG-NG和HG-NG/Inh=20 mM D葡萄糖,然后是5 mM D葡萄糖,不含或含MMP-9抑制剂;L-G=20 mM l -葡萄糖;NG/利帕=5 mM d -葡萄糖+利帕霉素。*和# p分别< 0.05 vs. NG或HG
溶酶体清除被自噬体吞噬的受损线粒体[16,17];为了研究高糖对受损线粒体清除的影响,用LTR染色溶酶体和MTR染色线粒体来测定自噬体的形成。高糖组与正常葡萄糖组相比,溶酶体染色明显降低,HG- ng组仍处于亚正常状态(图3a和b)。与染色结果一致,与正常葡萄糖组相比,HG组和HG- ng组的LTR和MTR之间的Pearson相关系数也显著降低(p < 0.05;图3 c)。20 mM l -葡萄糖和5 mM d -葡萄糖的细胞具有相似的LTR强度和LTR- mtr Pearson相关系数。
图3
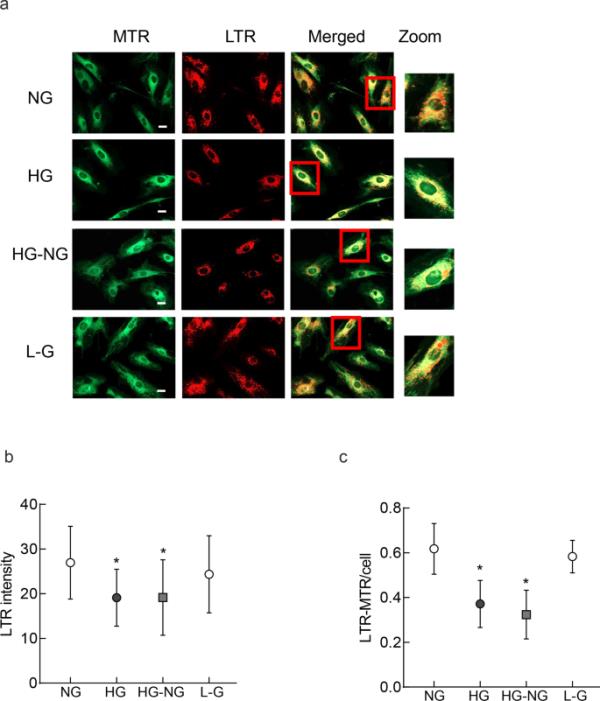
逆转高糖和自噬体的形成。用嗜酸荧光探针LysoTracker标记的溶酶体(LTR,红色)和用MiroTraker标记的线粒体(MTR,绿色)使用20 ×物镜(比尺=20μm)成像。b绘制LTR平均强度,c绘制LTR与MTR强度之比。每个实验在3种不同的细胞制剂中重复,每组/制剂成像6-8个细胞
根据线粒体自噬体的形成,与正常葡萄糖相比,高糖细胞的线粒体自噬通量减少,Mtphagy dye染色减少(图4a), HG组的线粒体自噬染料强度以及Mtphagy与Lyso- dye之间的Pearson相关性明显低于NG组(图4b和c)。高糖与正常葡萄糖的逆转(HG-NG组)未能阻止线粒体自噬通量的减少。在高糖(HG/Inh组)或在高糖(HG- ng /Inh组)之后的正常葡萄糖暴露期间补充MMP-9抑制剂,改善了线粒体自噬的减少。HG组和HG- ng组间差异无统计学意义(p > 0.05),与HG/Inh组和HG- ng /Inh组间差异有统计学意义(p < 0.05)。20 mM l -葡萄糖和5 mM d -葡萄糖处理的细胞无明显差异。
图4
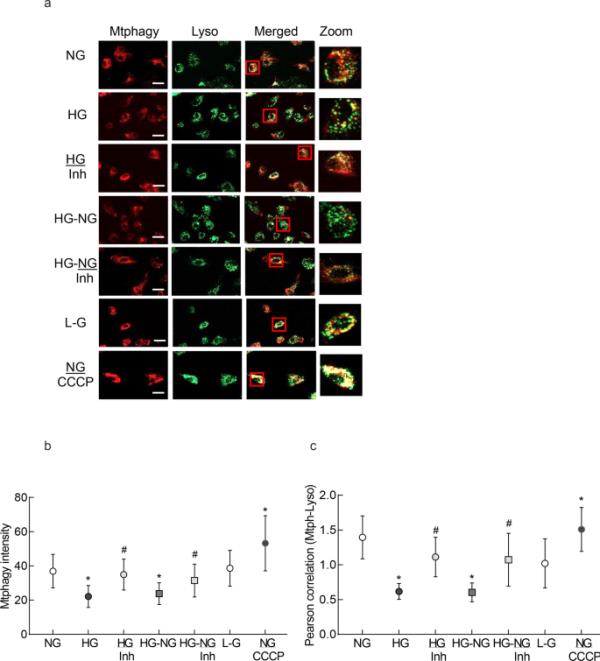
高糖逆转对线粒体自噬通量的影响。使用20 ×物镜(比尺=20μm)对Mtphagy Dye和Lyso Dye染色的视网膜内皮细胞进行成像。b绘制了Mtphagy染料的算术平均强度和c绘制了Mtphagy与Lyso染料的Pearson相关系数。从3到4个细胞制剂中获得的值为平均值±SD,每次测量都是重复的。NG=5 mM d -葡萄糖;HG和HG/Inh=20 mM d -葡萄糖,不含或含MMP-9抑制剂;HG-NG和HG-NG/Inh=4天20 mM D-葡萄糖和4天5 mM D-葡萄糖,不加或加MMP-9抑制剂;L-G=20 mM l -葡萄糖;NG/CCCP=5 mM d -葡萄糖+羰基氰化物间氯苯腙。*和# p分别< 0.05 vs. NG或HG
如先前报道的[15,21],连续血糖控制不良6个月的大鼠(PC组),与Norm组或GC组(分别为~ 520 g, ~ 110 mg/dl和< 15 ml/24 h)相比,体重(~ 320 g)明显降低,血糖(~ 400 mg/dl)和尿量(> 120 ml/24 h)显著增加。在血糖控制不佳的3个月期间,PC-GC组大鼠的体重、血糖和尿量与PC组相似,血糖控制良好的3个月后,这些大鼠的数值与Norm组或GC组相似。正常组与GC组大鼠代谢指标差异均无统计学意义(p > 0.05)。
流式细胞术线粒体自噬分析显示,与正常大鼠相比,糖尿病大鼠视网膜中MitoTracker深红色的散射显著减少,血糖水平较差的血糖逆转为良好的血糖(PC-GC组)未能提供任何益处;PC组与PC- gc组间差异无统计学意义(p > 0.05),但与正常组间差异有统计学意义(p > 0.05)。糖尿病诱导后不久良好血糖控制(GC组)值与正常大鼠无显著差异(p > 0.05;图5a和b)。
图5
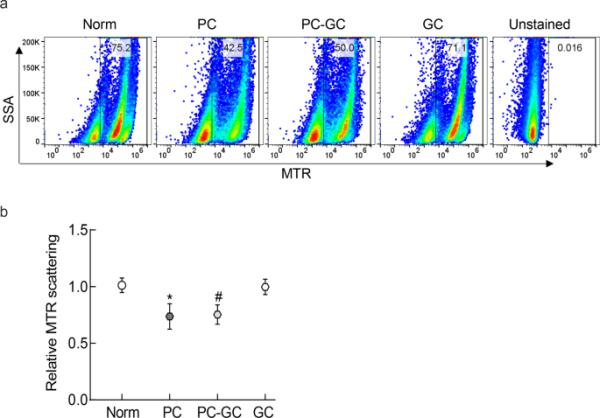
糖尿病大鼠血糖恢复正常对线粒体自噬的影响。在视网膜细胞制备过程中,采用MitoTracker深红色流式细胞术检测细胞自噬情况。使用FlowJo v10.8.1软件分析原始流式细胞仪标准文件,绘制散射的相对折线变化(SSA=侧散点A)。每组5 - 7只大鼠的数值以mean±SD表示。Norm=正常;PC=连续6个月血糖控制不良的大鼠;PC-GC=连续3个月血糖控制不良的大鼠,随后3个月血糖控制良好的大鼠;GC=连续血糖控制良好6个月的大鼠。*p < 0.05与正常或GC相比,#p > 0.05与PC相比
糖尿病患者线粒体功能失调,DNA受损,在糖尿病视网膜病变发病过程中,线粒体损伤加速毛细血管细胞凋亡,先于糖尿病视网膜病变的组织病理学特征发展[32]。由于mtDNA的损伤,mtDNA编码基因的转录减少,电子传递链系统受损,导致自由基的自我繁殖恶性循环,视网膜病变继续发展[9,10,13]。线粒体质量控制对细胞完整性至关重要,由于受损的线粒体继续产生活性氧,清除这些受损/功能失调的线粒体对于维持线粒体种群的功能至关重要。在这里,我们令人兴奋的结果表明,即使在去除高血糖损伤后,受损线粒体的清除率仍然低于正常水平;线粒体的周转仍处于次优状态,随着自噬体形成的减少,自噬过程继续受到损害。然而,在逆转阶段,通过抑制与线粒体损伤有关的酶MMP-9的激活来预防线粒体损伤[19],可以改善线粒体周转的减少,并改善线粒体自噬过程。结果在大鼠模型中得到证实,即使在3个月的良好血糖控制之后,线粒体自噬仍然受损,这是在3个月的不良血糖控制之后,清楚地表明,在血糖控制不良期间启动的受损线粒体的不良更新/清除并没有从高血糖损伤的终止中受益,并提示其在代谢记忆现象中所起的作用与糖尿病视网膜病变的持续进展有关。
线粒体质量控制由两个相反的过程调节,即去除受损的细胞器或其成分,以及线粒体生物发生形成更多的线粒体。线粒体周转率反映了降解与线粒体生物发生的总和,随着受损的线粒体继续产生更少的ATP和更多的ROS,线粒体周转率对细胞稳态至关重要[22,33,34]。我们之前的研究表明,视网膜线粒体生物发生在糖尿病中受损,即使在高血糖损伤终止后也会继续受损,从而导致代谢记忆现象[35]。在这里,我们发现高葡萄糖也会损害线粒体的周转,即使当高葡萄糖的损伤被正常葡萄糖所取代时,周转仍然是次优的。为了支持这一观点,在基因操纵的糖尿病小鼠模型中观察到更高水平的视网膜线粒体降解[36],并且自由基的恶性循环不会从高糖损伤的终止中获益[7,10,37]。
受损的线粒体既可以通过线粒体自噬降解,也可以通过线粒体动力学修复[38]。线粒体是非常动态的,这对于分离其功能和受损元素非常重要[39],在糖尿病视网膜病变中,视网膜线粒体动力学不平衡,裂变增加,融合减少。此外,高血糖损伤的逆转并不有利于裂变融合过程,线粒体仍然碎片化[15,21]。线粒体自噬,受损的线粒体被双膜自噬体“线粒体自噬体”吞噬以进行溶酶体降解的过程[16,17,18]。在正常生理条件下,线粒体自噬在基础线粒体的更新和维持中起着至关重要的作用,并可受到多种病理刺激的刺激[40,41]。线粒体自噬受损或不足导致线粒体功能不良/受损,ATP生成不理想,ROS水平高,而线粒体自噬增加导致线粒体数量减少[42,43]。据报道,线粒体自噬缺陷在许多疾病的发病机制中,特别是与年龄相关的散发性疾病,如帕金森病、阿尔茨海默病和心肌病[44,45,46]。如前文所述,糖尿病患者视网膜线粒体受损,膜电位降低,动力学失衡,线粒体损伤不会因高血糖终止而中断[9,10,13]。在这里,我们发现高葡萄糖也减弱了线粒体自噬体的形成,减少了受损线粒体的去除,而正常葡萄糖的高葡萄糖逆转对受损线粒体的去除没有任何好处,进一步促进了受损线粒体的持续积累。
糖尿病视网膜病变中MMPs的激活与线粒体损伤有关,抑制MMP-9可防止糖尿病小鼠线粒体损伤和视网膜病变的发生[19,47]。我们的研究结果表明,在高糖暴露后的正常葡萄糖暴露期间,MMP-9抑制剂直接抑制线粒体损伤,恢复线粒体更新和线粒体自噬过程,进一步支持线粒体自噬在与糖尿病视网膜病变持续进展相关的代谢记忆中的作用。因此,在大鼠代谢记忆模型中,在血糖控制良好之后,硫辛酸对线粒体损伤的直接调节可以恢复线粒体生物发生。此外,在良好的血糖控制期间补充Dnmt抑制剂可以防止Mitofusin 2(一种线粒体融合蛋白)的下调,通过防止其启动子的DNA超甲基化。在相同的代谢记忆实验模型中,这些疗法也能阻止糖尿病视网膜病变的进展[6,35]。
代谢记忆动物模型的类似结果显示,即使在一段时间的高血糖后恢复正常血糖后,线粒体功能和生物发生仍处于亚正常状态[35],表明线粒体自噬过程持续受损,进一步证实了线粒体自噬在代谢记忆现象中的作用。血糖控制不佳的糖尿病患者早期强化血糖控制可减少视网膜病变的进一步进展,即使在几十年后,前DCCT强化治疗参与者的视觉功能也比前常规组更好[48]。同样的现象也出现在动物模型中;糖尿病后不久建立良好的血糖控制可以保护线粒体功能障碍和碎片化,并防止糖尿病视网膜病变的持续发展[5,21,35]。在这里,我们发现GC组大鼠的线粒体自噬与正常大鼠相似,进一步支持糖尿病患者早期和持续良好的血糖控制的重要性。
我们认识到,我们的研究主要集中在代谢记忆中的线粒体自噬过程,但我们不能排除与受损线粒体去除相关的其他途径的作用,包括蛋白酶体降解受损的线粒体外膜蛋白,或线粒体来源的囊泡与溶酶体融合以降解氧化的线粒体蛋白[49,50];它们在糖尿病视网膜病变进展中的作用仍有待研究。
总之,实验模型的结果表明,线粒体自噬在与糖尿病视网膜病变持续进展相关的代谢记忆现象中发挥了重要作用。由于不良的周转和受损线粒体的移除,功能失调的线粒体继续积累,电子链系统仍然受损,ROS继续产生。去除高糖损伤对线粒体自噬过程没有帮助,质量差的线粒体继续产生ROS(图6)。此外,维持早期和持续的良好血糖控制可以防止受损线粒体的积累,从而加强了严格和持续血糖控制的重要性。然而,在良好的血糖控制过程中,直接预防线粒体损伤,可以改善线粒体更新,促进线粒体自噬,这为患者减缓/停止糖尿病视网膜病变的进展,防止视力丧失提供了可能的额外治疗机会。
图6
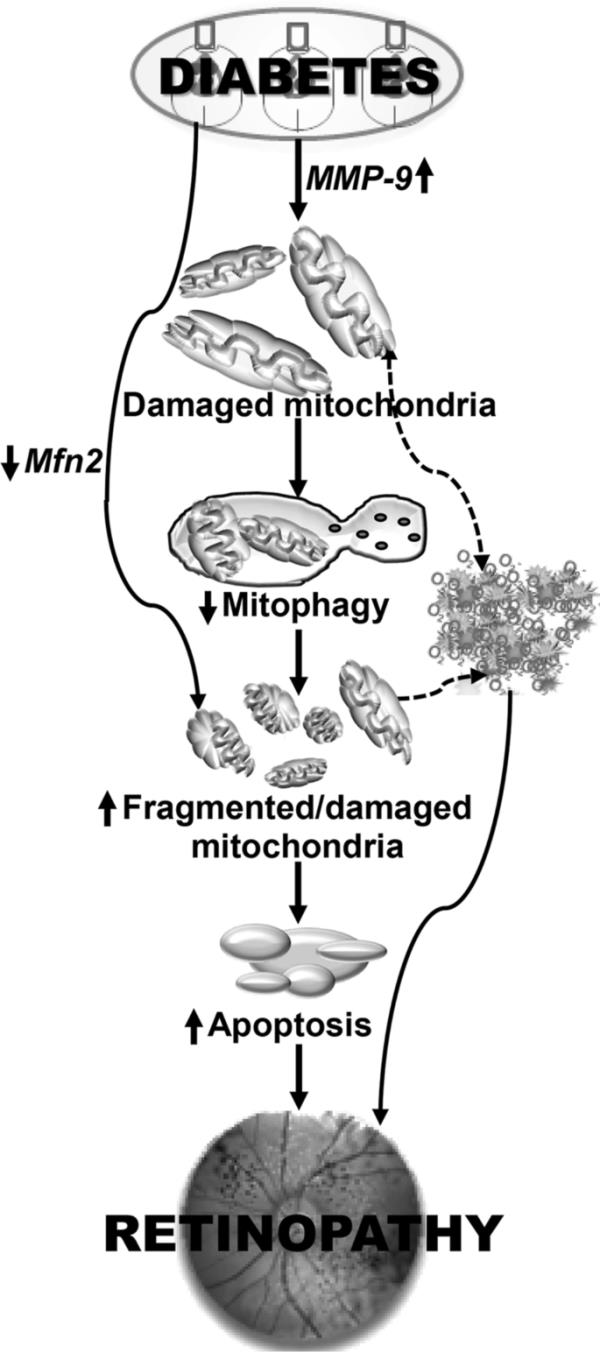
工作模型。糖尿病激活MMP-9并破坏线粒体,受损的线粒体自噬过程无法清除受损的线粒体。线粒体损伤加速毛细血管细胞凋亡,导致视网膜病变的发生。此外,线粒体动力学也不平衡,抑制线粒体融合蛋白mitofusin 2 (Mfn2),导致碎片化的线粒体进一步积累,导致ROS持续积累。高血糖损伤的终止并不会中断,受损/碎片化的线粒体产生的ROS继续加速细胞死亡,未能对糖尿病视网膜病变的进展提供任何益处
下载原文档:https://link.springer.com/content/pdf/10.1007/s12035-023-03534-1.pdf