现在已经确定,肥胖与前列腺癌(PCa)的高风险相关。脂肪组织和前列腺癌之间的串扰已经被观察到,但仍然缺乏表征。本研究表明,3T3-L1脂肪细胞条件培养基(CM)可以通过刺激PC3和DU145 PCa细胞的成球能力和促进CD133和CD44的表达,从而赋予PC3和DU145 PCa细胞干细胞性。此外,暴露于脂肪细胞CM后,两种PCa细胞系都经历了部分上皮向间质转化(EMT),伴有E-/ n -钙粘蛋白开关和Snail上调。具体而言,PC3和DU145细胞表型的这些变化伴随着肿瘤克隆活性和存活的增加,以及侵袭性、抗异型性和基质金属蛋白酶(MMP)产生的增强。最后,脂肪细胞cm处理的PCa细胞对多西他赛和卡巴他赛的反应性降低,显示出更大的化疗耐药。总的来说,这些数据表明脂肪组织可以通过重新编程癌症干细胞(CSC)机制有效地促进前列腺癌的侵袭性。
脂肪细胞赋予前列腺癌细胞干细胞样特性和间质特性,增强其致瘤性、侵袭性和化疗耐药性。
前列腺癌(PCa)通常是一种惰性恶性肿瘤,有多种治疗选择。对于侵袭性较低的肿瘤患者,主动监测仍然是首选方法,局部癌可以通过手术、放疗或雄激素剥夺治疗成功治疗(Horwitz和Hanks 2000;Perlmutter and Lepor 2007;Lawrentschuk et al. 2010)。然而,约40%的患者经历疾病复发,肿瘤发展为去势抵抗状态,其特点是侵袭性高,转移潜力增加,预后差(Fontana et al. 2020;Fontana and Limonta 2021)。因此,迫切需要更深入地了解前列腺癌进化的机制,目前许多研究都集中在识别特定的分子特征,这些分子特征可能是特殊治疗的目标(Fontana et al. 2022b)。
前列腺癌的几个危险因素已经被确定。这些因素包括年龄、种族/民族和家族史(Leitzmann and Rohrmann 2012)。肿瘤抑制基因和致癌基因的获得性或遗传性基因改变也与发生这种癌症的风险有关(Fontana等人,2022b)。另一方面,在前列腺癌发生或发展的众多可改变因素中,肥胖是研究最广泛的因素之一。
在过去几年中,肥胖已达到流行病的程度,全世界有近20亿成年人超重,其中6亿人肥胖(Chooi et al. 2019)。这种情况是由遗传易感性和环境的复杂相互作用造成的,热量摄入增加和身体活动减少导致慢性能量失衡和功能失调脂肪量的扩大(Hruby等人,2016;Lin and Li 2021)。尽管过度超重与前列腺癌突变之间是否存在特定联系仍存在争议,但肥胖与更具侵袭性的肿瘤和有限的治疗效果广泛相关(Freedland and Aronson 2004;Cao and Giovannucci 2016;Ferro et al. 2017;Nassar et al. 2018;est
et al. 2020)。人们提出了几种机制来解释这种相关性,包括高胰岛素血症、脂肪因子过量产生和激素合成增加(Freedland and Aronson 2004;Cao and Giovannucci 2016;Ferro et al. 2017;Nassar et al. 2018;est
et al. 2020)。然而,关于肥胖驱动PCa进化的具体表型变化和信号通路的数据仍然很少,只有少数研究报道了一些促肿瘤蛋白,如HIF、JNK和JAK/STAT级联,参与脂肪到肿瘤细胞的通讯(Dumas和Brisson 2021)。特别是,脂肪细胞对癌症干细胞(CSC)机制的影响,即负责肿瘤转移和化疗逃逸的细胞室(Skvortsov et al. 2018),尚未得到研究。
在本研究中,我们进一步剖析了脂肪组织和前列腺癌之间相互作用的生物学机制,重点关注了肿瘤向侵袭性表型转变过程中涉及的细胞和分子改变。
多西他赛和卡巴他赛来自Sigma-Aldrich(米兰,意大利)。
一抗CD133(64,326)、CD44(3570)、MMP2(4022)、MMP9(3852)、E-cadherin(3195)、N-cadherin(13,116)、Snail(3879)来自Cell Signaling Technology Inc. (Danvers, MA, USA)。α-Tubulin (T6199)来源于Sigma-Aldrich。所有抗体均按1:1000的浓度使用。
辣根-过氧化物酶偶联二抗和增强化学发光试剂来自Cyanagen(博洛尼亚,意大利)。
PC3和DU145 PCa细胞来自American Type Culture Collection (ATCC, Manassas, VA, USA),分别在分别添加7.5%和5% FBS、谷氨酰胺和抗生素的RPMI培养基中,在37°C 5% CO2/95%空气的湿化气氛中培养。3T3-L1前脂肪细胞也来自ATCC,在添加10%胎牛血清、谷氨酰胺和抗生素的DMEM培养基中生长。原始细胞储存在液氮中冷冻。复苏后,细胞培养时间不超过10-12周。胰酶- edta溶液分离,每周传代一次。
3T3‐L1前脂肪细胞分化通过用含有10% FBS和500μM 3‐异丁基‐1‐甲基黄嘌呤、1μM地塞米松、1μg/ml胰岛素和1μM罗格列酮的诱导培养基代替常规培养基开始。3天后,用含有10% FBS和1μg/ml胰岛素的DMEM代替诱导培养基,细胞继续生长4天。之后,成熟脂肪细胞在常规培养基(含10% FBS的DMEM)中再维持3天。最后,用无血清DMEM更换培养基:24 h后,收集条件培养基(CM),保存于- 80°C。以无血清DMEM作为对照。
用脂肪细胞CM预处理PCa细胞24 h,然后在低贴壁25-cm2的瓶中(5 × 105个细胞/瓶),用含10 ng/ml重组人成纤维细胞生长因子、10 ng/ml重组人表皮生长因子、4μg/ml胰岛素和0.2% B27的无血清DMEM-F12孵育7天。用蔡司Axiovert 200显微镜对原球进行计数。
将PCa细胞(100-250个细胞/孔,取决于细胞类型)接种于6孔板中。48 h后,细胞用脂肪细胞CM处理72 h,然后在完全RPMI中培养7-10天。菌落用70%甲醇固定,0.15%结晶紫染色。
将PCa细胞(1.5 × 105个/皿)置于6 cm培养皿中。48小时后,用脂肪细胞CM处理96小时。然后收获细胞,用PBS洗涤,用Annexin V和PI孵育,使用eBioscience?Annexin V- fitc凋亡检测试剂盒。流式细胞术分析使用Novocyte3000仪器(ACEA Biosciences, San Diego, CA, USA)进行。数据分析采用Novoexpress软件。
将PCa细胞(5 × 104)接种于6孔板中,在脂肪细胞CM中培养96 h,光镜下观察细胞形态。使用蔡司Axiovert 200显微镜进行分析,使用连接Coolsnap Es CCD相机(Roper Scientific-Crisel Instruments, Roma, Italy)的20 × 1.4物镜观察细胞。
将PCa细胞(1.5 × 105个/皿)置于6 cm培养皿中。48 h后,用脂肪细胞CM处理24 h。然后收获细胞,在无血清培养基中重悬,置于Boyden室上室的开底孔中。化学引诱剂(FBS 5%)放置在室的下室。两个隔室采用不含聚乙烯吡咯烷酮的聚碳酸酯多孔膜(8-μm孔),预涂明胶(0.2 mg/ml PBS)。将培养皿在培养箱中保存6小时,固定膜下表面浸润的细胞,用Diff-Quick染色试剂盒(DADE, Dudingen, Switzerland)进行染色,随机选择三个显微镜视野进行计数。
将PCa细胞(5 × 104)接种于超低贴壁24孔板中,在脂肪细胞CM中培养48小时。然后收获细胞,用台锥蓝0.4% (1:1 v/v)染色,用Luna自动细胞计数器(Logos Biosystems, Annandale, VA, USA)计数。
以3 × 104个细胞/孔的密度在24孔板中接种细胞。48 h后,用脂肪细胞CM预处理24 h,然后暴露于多西他赛(10 nM)或卡巴他赛(5 nM) 48 h,然后用MTT溶液(0.5 mg/mL)在不含酚红和FBS的RPMI中更换培养基;细胞在37℃下孵育30分钟,用异丙醇溶解紫色沉淀物。通过EnSpire多模平板阅读器(PerkinElmer, Milano, Italy)测量550nm处的吸光度。
细胞以5 × 105个/皿的速度接种于10‐cm的培养皿中。每次处理后,在RIPA缓冲液中裂解;蛋白制剂(25μg)在SDS - PAGE上分离,转移到硝化纤维素膜上。膜与特异性一抗孵育。检测采用辣根过氧化物酶偶联二抗和增强化学发光(Westar Etac Ultra 2.0, XLS075,0100, Cyanagen)。α-微管蛋白作为加载对照。
使用GraphPad Prism5统计软件包(GraphPad Software San Diego, CA, USA)进行统计分析。数据用三个独立实验的平均值±SEM表示。组间差异采用t检验或双向方差分析(ANOVA)进行评估,然后进行Bonferroni检验。P值< 0.05为差异有统计学意义。
摘要
介绍
材料与方法
结果
讨论
结论
参考文献
致谢
作者信息
道德声明
搜索
导航
#####
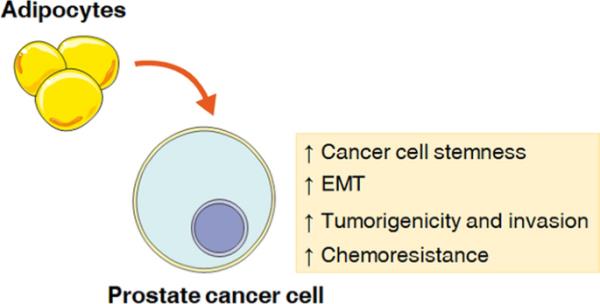
为了解释脂肪组织对肿瘤细胞的影响,我们首先将3T3‐L1前脂肪细胞分化为脂肪细胞。成熟脂肪细胞在无血清培养基中培养;24h后收集CM,检测其对PC3和DU145 PCa细胞株的影响。如图1A所示,3T3-L1脂肪细胞培养基显著促进肿瘤细胞球化能力,这是CSCs的典型特征。此外,还观察到干性标记CD133和CD44的富集(图1B)。因此,这些数据指出脂肪组织在确定PCa中茎样状态的叛乱中的关键作用。
图1
脂肪细胞促进前列腺癌细胞的干细胞化。(A) PC3和DU145细胞用脂肪细胞CM预处理24 h,然后在CSC培养基中培养7 d。用成球法测定癌细胞的成球能力。每个实验重复三次。比例尺尺寸为75μm。数据为平均值±SEM,采用t检验进行分析。*与PC3或DU145(对照)相比P < 0.05。**与PC3或DU145(对照)相比P < 0.01。(B)细胞用脂肪细胞CM预处理24 h,然后在CSC培养基中培养7 d。Western blot检测CD133和CD44在PC3和DU145细胞中的表达水平。微管蛋白表达作为加载对照进行评估。数据为平均值±SEM,采用t检验进行分析。*与PC3或DU145(对照)相比P < 0.05。**与PC3或DU145(对照)相比P < 0.01
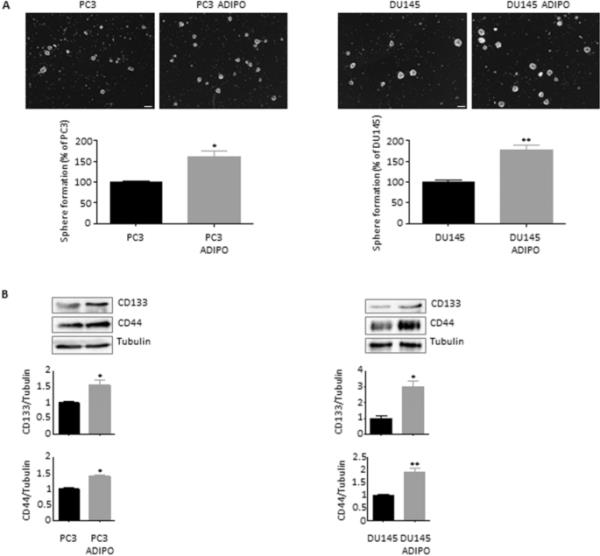
已知csc具有特定的自我更新和致瘤特性(Marzagalli et al. 2021)。根据这一概念,PC3和DU145细胞暴露于脂肪细胞CM之后,它们的克隆生成活性增加(图2A)。同样,与对照组相比,条件组的活细胞数量更高,自发凋亡率仅为2%(图2B)。总的来说,这些结果表明脂肪组织参与前列腺癌细胞的致瘤性和存活。
图2
脂肪细胞刺激前列腺癌细胞的致瘤性和存活。(A) PC3和DU145细胞用脂肪细胞CM预处理72 h,然后在合适的培养基中培养7-10天。采用集落形成法测定癌细胞的克隆生成活性。每个实验重复三次。数据为平均值±SEM,采用t检验进行分析。*与PC3或DU145(对照)相比P < 0.05。**与PC3或DU145(对照)相比P < 0.01。(B)细胞在脂肪细胞CM中孵育96小时,然后用eBioscience?Annexin V-FITC凋亡检测试剂盒(根据制造商的方案)染色后,通过细胞荧光分析评估凋亡率。每个实验重复三次。数据为平均值±SEM,采用t检验进行分析。***与PC3或DU145(对照)相比P < 0.001
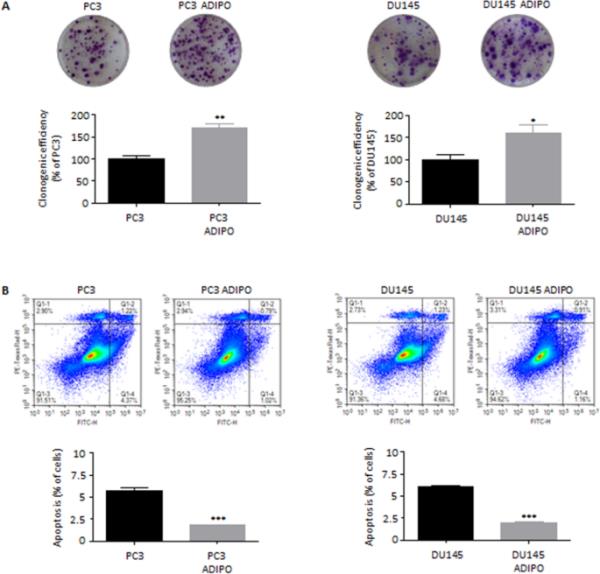
PCa进化与侵袭性表型的出现广泛相关,其特征不仅在于干细胞相关程序的激活,还在于细胞可塑性的改善(Skvortsov et al. 2018)。特别是,部分或全部EMT已被证明会推动前列腺癌转移和治疗逃逸(Montanari等,2017)。有趣的是,用脂肪细胞CM处理PC3和DU145细胞系导致获得细长的梭形形态,这是一种典型的间质样特征(Odero-Marah et al. 2018)(图3A)。在分子上,条件细胞表现出E-cadherin下调和N-cadherin过表达,表明向中间EMT状态转变(Odero-Marah et al. 2018);为了支持这一观察结果,还发现在PCa去分化过程中E-/ n开关的主要调节因子Snail水平的增加(Smith and Odero-Marah 2012)(图3B)。值得注意的是,这些促肿瘤级联反应的诱导通常与上述CSC特征的获得相关(Skvortsov et al. 2018)。
图3
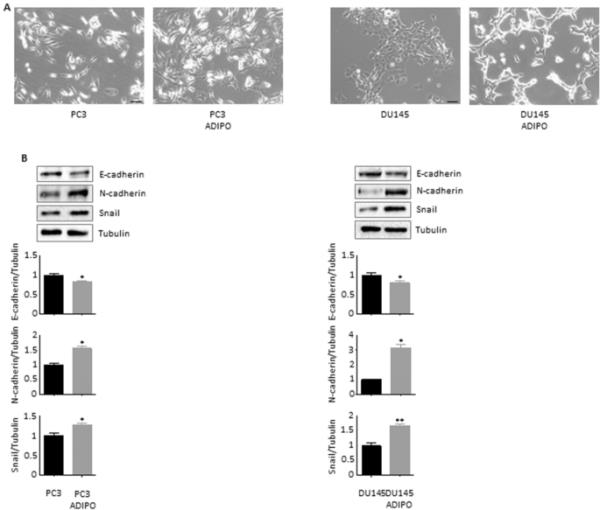
脂肪细胞赋予前列腺癌细胞间质特性。(A) PC3和DU145细胞在脂肪细胞CM中孵育96小时,光镜下观察细胞形态。每个实验重复三次。比例尺尺寸为40μm。(B)脂肪细胞CM处理24 h后,Western blot检测E-cadherin、N-cadherin和Snail在PC3和DU145细胞中的表达水平。微管蛋白表达作为加载对照进行评估。数据为平均值±SEM,采用t检验进行分析。*与PC3或DU145(对照)相比P < 0.05。**与PC3或DU145(对照)相比P < 0.01
鉴于癌症干细胞、EMT和肿瘤扩散之间存在着严格的联系(Fontana et al. 2019;Bakir et al. 2020),分析了cm处理的脂肪细胞癌细胞转移特性的变化。图4A强调了3T3-L1成熟脂肪细胞刺激PC3和DU145细胞系侵袭的能力。更重要的是,研究发现条件化的PCa细胞能够成功逃离anoikis, anoikis是由于缺乏正确的细胞/细胞外基质粘附而导致的一种依赖于锚定的细胞死亡形式(Paoli等,2013)(图4B)。正如预期的那样,这与维持转移的基质金属蛋白酶2和9 (MMP2和9)的激活是平行的(图4C)。再一次,这些发现证实了脂肪团可以促进前列腺癌转移性干细胞机制的假设。
图4
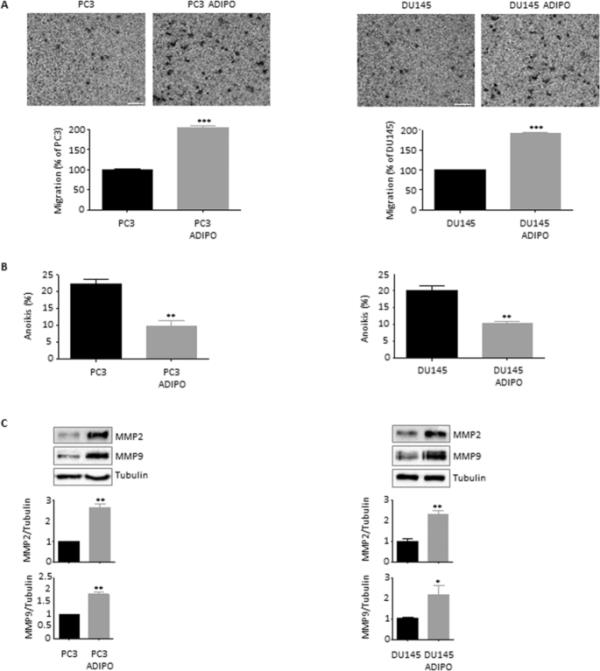
脂肪细胞驱动前列腺癌细胞侵袭。(A) PC3和DU145细胞在脂肪细胞CM中孵育24 h,用Boyden室法检测细胞侵袭情况。每个实验重复三次。比例尺尺寸为100μm。数据为平均值±SEM,采用t检验进行分析。***与PC3或DU145(对照)相比P < 0.001。(B)细胞在脂肪细胞CM中孵育48小时,然后用台盼蓝排斥试验评估Anoikis。每个实验重复三次。数据为平均值±SEM,采用t检验进行分析。**与PC3或DU145(对照)相比P < 0.01。(C)脂肪细胞CM处理后(24 h), Western blot分析MMP2和MMP9在PC3和DU145细胞中的表达水平。微管蛋白表达作为加载对照进行评估。数据为平均值±SEM,采用t检验进行分析。*与PC3或DU145(对照)相比P < 0.05。**与PC3或DU145(对照)相比P < 0.01
CSC生态位不仅是肿瘤转移的主要驱动因素,而且是肿瘤耐药的主要调节因子。在这方面,暴露于脂肪细胞CM的PC3和DU145细胞显示出对多西他赛和卡巴他赛的敏感性降低,这两种化疗药物通常用于PCa治疗(图5A和B)。总的来说,这一证据证实了脂肪组织直接作用于PCa CSC程序的能力,增强了肿瘤的侵袭性。
图5
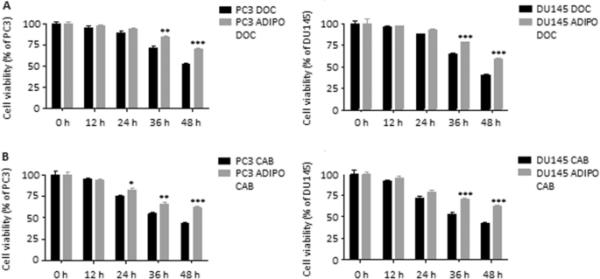
脂肪细胞赋予前列腺癌细胞化疗耐药性。(A) PC3和DU145细胞在脂肪细胞CM中孵育24 h,然后用多西紫杉醇(10 nM)处理48 h, MTT法测定细胞活力。每个实验重复三次。数据为平均值±SEM,采用双因素方差分析,然后进行Bonferroni检验。**与PC3 DOC或DU145 DOC(对照)相比P < 0.01。***与PC3 DOC或DU145 DOC(对照)相比P < 0.001。(B) PC3和DU145细胞在脂肪细胞CM中孵育24 h,然后用卡巴他赛(5 nM)处理48 h, MTT法测定细胞活力。每个实验重复三次。数据为平均值±SEM,采用双因素方差分析,然后进行Bonferroni检验。*与PC3 CAB或DU145 CAB(对照组)相比P < 0.05。**与PC3 CAB或DU145 CAB(对照)相比P < 0.01。***与PC3 CAB或DU145 CAB(对照)相比P < 0.001
下载原文档:https://link.springer.com/content/pdf/10.1007/s12079-023-00738-x.pdf



