花卉附属物显示一系列形状和大小。在这些器官中,雄蕊是形态多样的结构,已经失去了产生花粉的能力,但在某些情况下,它们产生可育的花粉粒。在仙人掌科中,雄蕊并不常见,其结构范围从简单的线性到扁平再到匙形,但描述其结构属性的研究很少。本研究强调了同步辐射在样品制备和作为植物生物学研究工具方面的优势。利用同步辐射微计算机断层扫描(SR-μCT)技术,研究了平原刺梨仙人掌(Opuntia polyacantha)花部的内部形态,特别是雄蕊、花被和雄蕊。分析了生殖器官三维重建成像的不同解剖特征,并讨论了利用SR-μCT检测和表征花被部和雄激素部血管网络及其相关结构的构型和复杂模式的分割方法的优势。这项强大的技术在分辨率方面带来了实质性的改进,使人们能够更全面地了解O. polyacantha花部分脉管系统和雄蕊开始的解剖组织。花被部和雄蕊部有单叶表皮包裹着疏松的叶肉,叶肉有粘液分泌管、管腔和分散的维管束。隐的潜在结构特征提供了维管化假药与花被合生的证据。雄蕊附属物(假花药)的轮廓不明确,与花被片模糊的边界融合在一起,这表明雄蕊起源于花被片,这一发育模式支持被子植物花器官身份的褪色边界模式。
利用高分辨率的x射线计算机断层扫描技术在二维和三维空间可视化植物结构的多种成像技术的出现(Heeraman等人,1997;Dhondt et al. 2010;Mooney et al. 2012),中子射线照相(Oswald et al. 2008;Leitner et al. 2014)和磁共振成像(Pohlmeier et al. 2008;Borisjuk et al. 2012)在理解植物部分和器官的复杂组织方面取得了重大进展。
同步加速器光束线的独特特性,如高亮度、强极化、宽且可调谐的能量谱和时间结构发射,结合光学技术的进步,已经取得了重大发现,例如药物结构(Hubbard 2008)、癌症诊断和治疗(Heidari和Gobato 2019)、COVID-19结构(Baker 2020)和其他医学发现(Kaushik和Raj 2020)。基于同步辐射的技术也逐渐被用于植物科学的不同目的,揭示了新的叶脉网络(Blonder等人,2012)、草酸钙晶体(Matsushima等人,2012)、根生长(Leitner等人,2014)、细胞壁(Hiraki等人,2018)、固氮豆科根瘤中的硫积累(Rivard等人,2019)、宿主-病原体相互作用(Brar等人,2019)以及细胞器的定位和定量(Lombi和Susini 2009;Karunakaran et al. 2015),以及其他调查。
利用同步辐射进行光谱成像是目前研究文化和自然遗产材料的主要趋势之一,因为它可以应用于自然历史收藏品中的保存标本。基于同步辐射的微计算机断层扫描(SR-μCT)适用于非破坏性现存和化石样本的形态学研究(Smith et al. 2009),使其成为检查生物样本外部和内部结构的理想工具,在广泛的领域,包括生物学,医学,古生物学和许多工程学科,因为它可以提供解剖学,功能和疾病检测的见解。在这种情况下,加拿大光源公司(https://www.lightsource.ca)的生物医学成像和治疗弯曲磁铁(BMIT-BM 05B1-1)设备的多用途性使其适合于许多植物标本,因为先进的成像模式允许以传统系统无法实现的方式进行可视化。例如,它可以进行超快的CT扫描,比实验室扫描仪快100倍,它可以实现非常高的空间分辨率(尺寸小于1微米的样本特征可以被分辨出来),并且它可以区分在常规实验室和临床x射线扫描仪成像时通常不会表现出对比度的软组织。总的来说,这个成像站有能力加速材料科学、环境、博物馆收藏和生命科学领域的研究,因为它可以轻松地对大小标本进行高时空分辨率的成像。此外,该设备的光谱范围能够穿透大而厚的标本,并避免了通常冗长的人工制备植物组织的一些步骤,例如脱水、切片和使用可能对人体健康有害的化学固定剂,例如福尔马林。
目前,利用同步加速器技术对仙人掌进行营养和生理方面的研究很少。其中包括使用微融合x射线荧光和化学测绘(Ba?uelos等人,2011年,2012年)调查刺梨果实(Opuntia ficus-indica)中硒的积累、分布和物种形成,使用傅里叶变换红外进行纳米纤维素表征(Orrabalis等人,2019年),以及处理O. microdasys的水力导电性方面(Kim等人,2018年),但据我们所知,仙人掌的花部分尚未使用该技术进行检查。由于BMIT的优势,本研究采用同步加速器x射线微成像技术对平原刺梨仙人掌(Opuntia polyacantha Haw)花部的形态解剖指纹进行可视化和比较。(仙人掌科),特别是规则的雄蕊和发育中的雄蕊,这是大约三分之一的被子植物物种中独特的花卉发明(Walker-Larsen and Harder 2000)。
早前曾有报道称,多刺仙人掌花中存在雄蕊(Cota-Sánchez et al. 2013),但最近对普通花和雄蕊花的扫描电镜研究表明,这种多刺仙人掌的雄蕊形状不同,来自雄蕊部分,特别是来自可育雄蕊,经过一系列涉及逐渐变宽的转变(Rice et al. 2022)。本研究的目的是进一步探索该仙人掌雄蕊花的雄蕊部分。本研究的主要目的是:(1)应用同步加速器技术研究多棘花正常雄蕊和发育中的雄蕊的形态和维管化;(2)确定该物种中雄蕊的推测来源。本研究对这些附属物进行了正式的显微形态学检查,从而更好地了解了仙人掌科花部的起源和进化。它还提供了对正常雄蕊和雄蕊中复杂的维管化网络的更广泛的理解,并突出了同步辐射在研究柔软,精致的花组织中的好处。
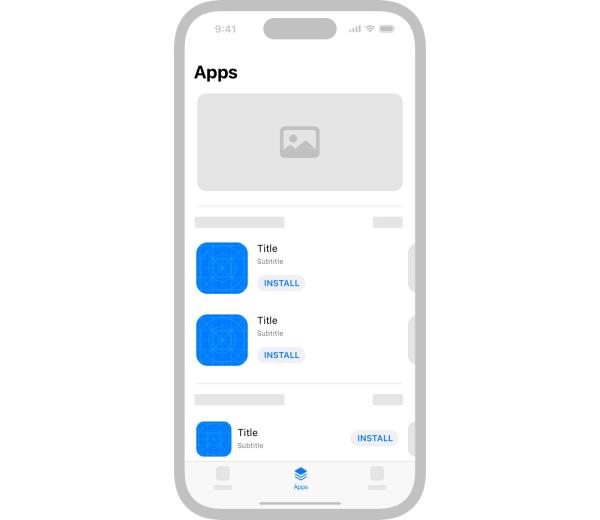
本研究使用的是在加拿大萨斯喀彻温省萨斯katoon以南约20公里处采集的O. polyacantha的花,这些花来自于坐标51°55 ' 57″N和106°44 ' 11″w附近的种群。该物种原产于草原栖息地,在南/东南暴露的起伏丘陵和干燥沙质土壤的库利河岸上茁壮成长(Cota-Sánchez 2002)。花期从六月中旬开始,持续约4-5周。花蕾从沿茎尖边缘的枝状花序上部的微孔中萌发,单生或成小群(图1A, B),大约在上午10点左右开放,晚上闭合。
图1

在野生的多刺仙人掌属植物,有规则花(A)和雄蕊花(B)。注意雄蕊花的花尺寸较大。C雄蕊花,显示雄蕊轮生(0=外;Mo=中外;mid-inner;I=内螺纹(s))。D .聚棘花中具有代表性的雄蕊系列。从最内层雄蕊轮生开始,由左至右依次排列,正常雄蕊逐渐变为花被状雄蕊,最后为正常花被。Bf,雄蕊具宽花丝;c,连生雄蕊;f,分叉的雄蕊(双叉和三叉);年代,雄蕊;Sf,分离长丝;t,被片。A和B中的比例尺=2厘米。C和D中的比例尺=1cm。照片C和D由Rice et al.(2022)授权。《巴西医学杂志》45:665-678
该物种具有辐射对称雌雄同体的规则和雄蕊花。本研究利用了雄蕊型,因为除了常规雄蕊外,雄蕊样结构的存在是不寻常的。有代表性的凭证样本(Acc。不。支持本研究的资料(SASK 180957)保存在萨斯喀彻温大学W.P. Fraser植物标本馆(SASK)的永久收藏中。
同步扫描时,将常规的雄蕊、雄蕊等花器官解剖固定在70%的EtOH中,直至颜色完全褪去,然后将雄蕊和雄蕊从花杯上解剖,从中心(最内)轮向外,分别置于1.5 ml的Eppendorf管中。然后根据Rice et al.(2022)对样品进行脱水。然后,按照Almeida et al.(2012)的方法,用液态CO2 (Polaron Instruments E3000)对样品进行临界点干燥,并粘贴在铝桩上。
样品制备完成后,诊断方法包括对雄蕊和花被样雄蕊进行同步加速器x射线相衬成像或SR-μCT观察其显微形态。图像采集于BMIT-BM, 05B1-1。05B1-1弯曲磁体光束线产生的x射线光谱在12.6到40 keV (0.8-0.3 ?)之间,光束尺寸为240 mm (H) × 7 mm (V)。使用0.200 μm铝过滤的白光束产生的峰值通量约为20 keV。一个6.5 μm像素尺寸的PCO Edge 5.5 (2560 × 2048像素)CCD探测器,加上Optique Peter (Lentilly) 1.8 ×物镜和YAG(钇铝石榴石):Ce 200 μm厚的闪烁体,有效像素尺寸为3.61 μm,视场为9.24 mm2 (Chen et al. 2021)。在扫描开始时,共捕获了20张平面和暗图像,随后捕获了6000张360°以上的投影图像,同时样品与旋转轴偏移约4.5 mm,大致为模式水平场的两倍。这被称为半获取模式收集方法。
按照Vogelgesan et al.(2012)的方法,利用UFO-KIT软件和EZ- ufo、EZ_Stitch、EZ MView图形界面(https://ufo.kit.edu/dis/index.php/software/)完成所选雄花和雄花的图像处理和三维重建。半采集模式扫描需要首先水平缝合,以产生3000个缝合的投影图像和5个平面和暗图像。然后使用相位检索重建图像(Willick et al. 2020)。通过将拼接图像像素宽度除以2确定旋转中心。环形伪影(重建图像中的同心圆)的去除使用环形去除滤波器(“环形去除3”)进行抑制。直方图用于测试重建,以确定32位的最大和最小灰度值,用于转换为8位。相位检索图像的参数为:光束能量为20.0 keV,像素尺寸为3.61 μm,样品到探测器的距离为8 cm, δ/β=75。由此产生的1101幅图像代表了一个独立的雄蕊和tepaloid雄蕊图像,由多个垂直扫描组成,使用ImageJ缝合收集。使用Avizo 2020.2 (Thermo Scientific?Amira-Avizo?Software, Thermo Fisher Scientific, Waltham, MA, USA)对重建图像进行3D体渲染,以进一步清理重建工件数据,并从多个角度可视化staminode的结构部件,包括不同水平的横截面和全景360°视图。最后的图像编辑使用Adobe Photoshop CC2019,版本20.0.0进行。
摘要
介绍
材料与方法
结果
讨论
参考文献
致谢
作者信息
道德声明
补充信息
搜索
导航
#####
多刺仙人掌(Opuntia polyacantha)的植物长有两性规则花和雄蕊花(图1A, B),花被由3-5(6)组匙形花被片组成(图1A - c, 2(a))。雄蕊包含许多雄蕊,排列成同心系列。雄蕊由位于花杯上的分生环发育而成(图2(a)),并具有基生花药(图2(B))。在雄蕊花中,向外围方向,花药花丝逐渐变宽变平,形成花被片状结构(图1C, D;另见图2上面板的雄蕊系列,带有花粉粒的初生或原始花药。雄蕊的形状多种多样,有线形、细长形、短尖形、分叉形、截形和匙形(图1D)。这些附属物可能很多,靠近花被外围的附属物更大更宽,并倾向于模仿花被片的外观。单室子房有几个胚珠(图2(A))和一个带有几个乳突裂片的柱头(图2(C)),通常位于雄蕊上方,使花雌雄同体。
图2

多刺果属植物的花特性。(A)雄蕊花,雄蕊系列(上图)。(B)雄蕊上部微ct体积图。(C)柱头微ct体积图显示有乳突状裂片和附着花粉粒。体育:pericarpel;性病:退化雄蕊;stm:雄蕊;t:被片;机汇:卵巢。A中的比例尺=1cm。B和C中的比例尺=0.5 mm
三维重建结果表明,聚棘蕊的花丝具有分散在整条花丝上的小的外部乳头状突起,其表皮具有不同密度的细长细胞。花药表皮表面不规则,呈乳突状,其下有一层内皮。花药呈双掌状,由于花粉释放,每个花囊显示两个空的花粉囊(图3(A, B))。花药室之间的不育(结缔组织)具有维管束,是花丝的延伸。花丝的远端部分在与花药的附着点处收缩(图2(B)和3(A, B))。长丝的横截面显示其纵向的圆形性质,并具有贯穿整条纤维的几个解剖特征。这些包括致密的单层表皮,几层薄壁组织和松散的细胞,大的粘液分泌腔和中央维管束(图3(a - d)),可能是两壁型(木质部周围的韧皮部)。
图3
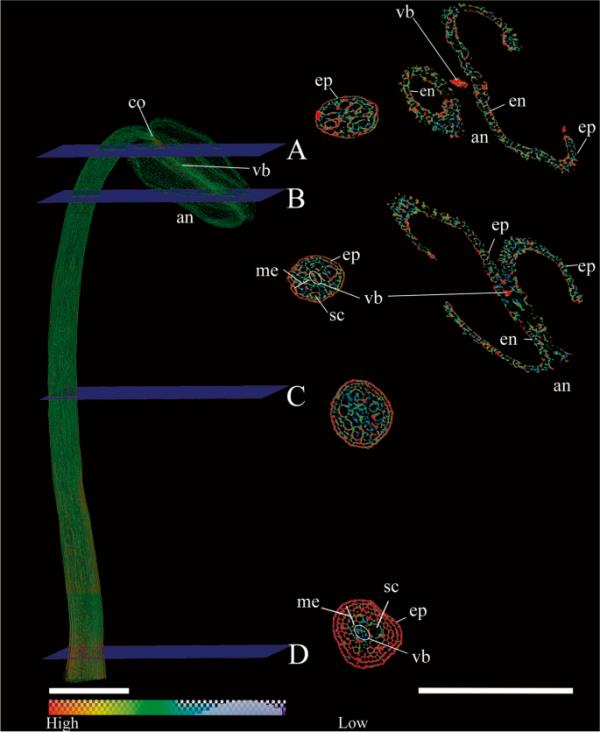
沿XY平面(a - d)四个不同截面的多棘机会花雄蕊微ct体积图显示花丝和花药的体积图。标签:安;花药;Co:结缔组织;en:内层;一个:花药;ep:表皮;f:长丝;我:叶肉;Sc:分泌细胞;Vb:维管束。色阶表示细胞密度。雄蕊的比例尺和截面的体积绘制=1毫米
花被片雄蕊的重建显示了一些用肉眼或光学显微镜不容易看到的结构(图4)。花被片的纵向视图显示,这种普通的叶状结构有许多表面的纵向拉伸纹。在花药顶端也观察到含有花粉粒(图5)的新生花药,即伪花药(图4(A))。细长花被片的内部组织和结构精巧而有组织。最外层是致密的单根表皮,向内是由松散细胞组成的叶肉,几个粘液分泌管和管腔,以及以小维管束为代表的分散的维管组织(图4)。这些解剖特征贯穿始终;然而,由于花被片底部较厚,因此在花被片基部的结构相对较大且更明显。总的来说,在花被片的不同部位和复杂的组织中,维管组织明显集中,可能是侧枝维管束,这有助于雄蕊及其部分(花丝和伪花药)的构象。
图4
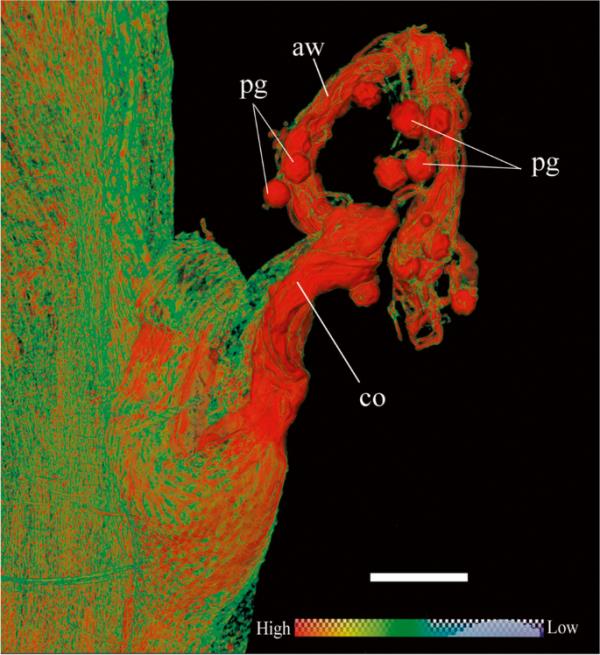
微ct体积图显示多棘仙人掌花被片和发育中的雄蕊(虚线)在沿XY平面的四个不同截面上显示前体结构(a - d)。缩写:aw:花药壁;ep:表皮;Fp:丝前体;我:叶肉;Pg:花粉粒;psa: pseudo-anther;Sc:分泌腔;Vb:维管束。色阶表示细胞密度。雄蕊的比例尺和截面的体积绘制=1毫米
图5

伪花药的显微ct体积绘制(图4中的psa结构)起源于多棘果花被片边缘。噢:花药壁;Co:连接区;加兰:花粉粒。标尺=300 μm
另一个明显的特征是存在从花被基部开始向上延伸到假药的细长分支构象(图4(A-D)中的虚线)。假药被一个血管化的区域包围(见图4(a)的横切面扫描)。在花被片基部附近形成分叉的另一侧,明显可见相同的无花药样结构的细长束束(图4(B-D))。这些延伸的元素包含相对较大的维管束。这是可行的,更健壮和血管化包是与新的雄蕊花丝起源的前体区域有关。花被片的最外层显示雄蕊的形成,这是前体的证据。两个附加的附属物存在于边缘,似乎与脉管系统有连续性,显然导致新的细丝的起源。假花药呈圆形,有许多花粉粒,由一个短的花梗状(柄)结构支撑(图5)。假花药是一个小的未分化的突起,其花药状结构在形态和大小上与普通花药不同。假花药和花丝状结构都是由于早期发育而微小的,起源于花被片而不是花托。
最后,在雄蕊(图3)和毡状雄蕊(图4)的重建中,可以看到粘液传导系统。在前者中,粘液腔呈圆形排列,位于丝上部靠近表皮的位置(图3(a - b))和位于丝基部2-4薄壁层下方(图3(C-D))。在绒样雄蕊中,粘液腔与维管束交织在一起。然而,在被认为是花丝(图4(D))和孢子囊(图4(a - b))“前体”的区域,我们发现了密度不同的细胞区域,这是由于雄蕊的形态组织与带有结缔组织和花粉粒的假药明显相连(图5)。此外,在特定区域,包括分泌细胞在内的细胞层数更高。表明细胞密度在中等到高的范围内,层数以圆形方式增加可能与细丝起始或前体结构的发育有关。
这项研究证明了同步辐射的最大优势之一,可以揭示传统显微技术无法感知的结构。它还在雄蕊和雄蕊的解剖组织和不同细胞成分的精确性方面提供了实质性的进展,并揭示了隐花的特征。
同步加速器x射线断层成像的空间分辨率足够高,可以准确地研究雄蕊和绒样雄蕊组织的复杂解剖结构。这些包括表皮、维管束元素、薄壁组织/叶肉组织和分泌细胞的存在。在仙人掌科的雄蕊结构中,维管系统的组织似乎有一个统一的解剖模式。与本研究中描述的相似的解剖特征,即花被片有几个小的侧枝,雄蕊有更多的由木质部组成的维管组织作为韧皮部,也在仙人掌科的陆生和附生世系中观察到,特别是在Cereus (Silva 2020)、Opuntia (Fuentes-Peres et al. 2009)、Epiphyllum phyllanthus (Almeida et al. 2010)、Hatiora和Rhipsalis (Almeida et al. unpub.)中。同样,Opuntia的花被片显示出几个维管束,这些维管束来自一个中心群,其大小与其他维管束不同(Rosas-Reinhold et al. 2021);因此,中央的维管束比其他的更大,与叶片中的维管束相当。因此,花丝的维管束比花被片内的单链更复杂是有道理的。在Opuntia (Fuentes-Perez et al. 2009)和E. phyllanthus (Almeida et al. 2010)的花被片中也观察到类似的脉管系统组织。最后,在整个雄蕊和花被片的横切面上,数字重建显示小的维管束,可能是侧枝型,即韧皮部束在木质部束的外侧,在同一半径上并排存在。这些分布在花被片和朝向假花药。另见补充视频1、2和3,显示雄蕊和花被片假药的慢动作检查。
另一方面,粘液物质的分泌细胞(异母细胞)在仙人掌科中很常见,但对该家族中这种传导网络的安排知之甚少。多棘花(雄蕊和花被)中复杂的维管网络和粘液通道的组织定位是重要的,因为这些元素缺乏气孔,但粘液导管的存在表明这种传导系统在花内和花周围的粘多糖分泌中起作用。事实上,在大多数仙人掌中,粘液是丰富的,特别是在茎上,在花的附属物,即花被部分,粘液较少(Mauseth 1983)。正如Fahn(2000)所指出的那样,外部通量吸引花的访客并促进授粉,因为它通常是在异母细胞中产生粘液,然后释放到外质体中(Trachtenberg和Fahn 1981, Nobel et al. 1992)。粘液的另一个重要作用是其复杂的亲水性质,由蛋白质和粘多糖组成,负责给组织补水,保护器官免受干旱(Terrazas and Mauseth 2002),促进水分运输(Nobel et al. 1992),这是在花期保持花朵膨胀的两个重要方面。我们推测,雄蕊花丝和花被片分泌细胞排出外体粘液的相同方法也可能在该物种所有花轮的水分运输和维持膨胀中起作用。
被子植物的发育研究表明,雄蕊起源于花的不同部位(Walker-Larsen and Harder 2000)。这些花的附属物已经在毛茛科的几个物种中进行了研究。例如,在Aquilegia中,雄蕊的形成伴随着邻近器官侧缘的物理相互作用,促进了它们的融合(Meaders et al. 2020)。Li etal .(2021)根据形状和花药大小将大花瓣铁线莲(Clematis macropetala)的雄蕊分为四种形式,即被花状雄蕊(St1)、匙形雄蕊(St2)、线形-匙形可育雄蕊(St3)和线形可育雄蕊(St4),它们在早期发育相似,但在后期逐渐分化。其中,前两种形式可以包括在本讨论的范围内,因为St1发育迟缓,缺乏花药分化(如O. polyacantha tepaloid staminode),而St2在花药分化的早期阶段发育异常,具有花药的原基,这也使人想起Rice等人(2022)报道的早期伪花药,并在这里进一步描述(图4和5A)。Li et al.(2021)的St1和St1的形态相似性以及O. polyacantha的tepaloid staminodes的形态相似性表明,这些结构在开始时的个体发育过程相似。
一些研究,如Ronse De Craene和Smets(2001)、Hufford(2003)、Endress和Mathews(2006)、Botnaru和Schenk(2019)、Meaders等人(2020)和Li等人(2021),都有助于理解开花植物的staminode结构、起源和发育。然而,除了Rice et al.(2022)和几篇关于仙人掌单性花中雄蕊附属物的一般性报道外,仙人掌科对雄蕊的深入描述有限。在仙人掌科中,雄蕊从花杯的一个主环开始离心生长(Ross 1982), Disocactus (Buxbaum 1953)和Schlumbergera truncata (Apol?nio 2022)的雄蕊现象就证明了这一点。最近对该科的发育研究报告称,非维管化的雄蕊起源于Denmoza rhodacantha花蜜室的上部(González et al. 2021),这与本研究中在O. polyacantha中看到的非维管化的雄蕊和花被片有很大的不同。
在Hylocereeae和rhipsalidae的成员中,特别是Selenicereus setaceus和Schlumbergera truncata,维管束系统也是由分布在花蜜和雄蕊(缺乏雄蕊的区域)的双侧维管束组成的(Apol?nio 2022;桑帕约和阿尔梅达,不公开。数据)。因此,导电组织延伸到花蜜下薄壁组织,这些组织分布在雄蕊的每个雄蕊花丝以及邻近的组织(花蜜、花管和雄蕊)中,合并在一个共同的维管网络中。相反,紫荆花蜜中的脉管系统显示出分枝木质部和韧皮部导管浸润花蜜薄壁的痕迹(González et al. 2021)。这些相互矛盾的数据表明,需要对仙人掌科其他类群进行进一步的研究,以充分了解维管系统的组织以及这些结构的共同或不同起源点的存在。
O. polyacantha被片和雄蕊形状多样的形态学基础可能是由于多个器官的复杂聚集(Rice et al. 2022),在一些被子植物中也是如此(Endress和Matthews 2006)。由于多棘豆雄蕊的起源可能涉及多个花系,因此考虑被子植物花发育的ABC模式是合理的。该模型假定b级基因控制花瓣和雄蕊的形成(Coen and Meyerowitz 1991)。在仙人掌科,花被是多系列的,由苞片和萼片结构衍生而来(Ronse De Craene 2013)。在Opuntia中,花有多肉的厚皮皮(花托组织),叶面器官向先端变成厚片状(Rosas-Reinhold et al. 2021)。因此,花被,显示从苞片到花瓣状附属物的进展,缺乏典型的绿色花萼和花冠的划分(Rice etal . 2022);因此,萼片和花瓣不能根据形态和颜色来区分(Hofmann 1994)。同样地,O. polyacantha的雄蕊在花被片和雄蕊之间有模糊的界限;因此,它们被认为是从雄蕊边缘的可育雄蕊经过一系列逐渐变宽的转变而形成的过渡器官。此外,根据Rice等人(2022)的研究,花轮的融合导致雄蕊和花被结构的融合,这表明O. polyacantha staminodes是过渡性的,因为它表现出多种特征的混合,支持同型而不是异位,这一观点也与Ronse De Craene(2003)的观点一致。
考虑到花被片的模糊边界和同步辐射图像显示的与花被片相连的雄蕊附属物的不明确性质,我们认为雄蕊起源于花被片,因为这种发育模式支持被子植物花器官身份的褪色边界模型。这种原型的特征是从苞片到花被片,从外部到内部花被片,以及从花被片到雄蕊的逐渐过渡(Soltis et al. 2007)。然而,鉴于发育和遗传学研究的缺乏,我们只能推测,在褪色边界模型中,O. polyacantha的雄蕊起源是由ABC基因的级联转录因子控制的。进化进化方法似乎非常适合在未来的研究中揭示该物种雄蕊起源的固有特性。
有限公司ncluding讲话
同步加速器微型计算机断层扫描通过断层成像方法提供了对O. polyacantha的显微形态的全面观察,超越了有用的外部描述。光束线允许可视化和成像新的隐植物部分,有助于查明假定的同源过程的起源和雄蕊的起始。相当简单的样品操作和对假定的花卉创新的表征进一步证明了这种创新的非破坏性同步加速器技术的价值和非凡的分辨能力,可以快速研究植物结构,而无需在标本制备中使用有毒或侵入性试剂。
图书馆的src="http://www.sjq321.com/news/78761/ / / e.video-cdn.net/v2/embed.js " > 多棘仙人掌正常雄蕊的微ct体绘制相机轨道。色阶表示细胞密度。 图书馆的src="http://www.sjq321.com/news/78761/ / / e.video-cdn.net/v2/embed.js " > 带有假花药的多棘果花被片的微ct体积绘制相机轨道:雄蕊的前体。色阶表示细胞密度。 图书馆的src="http://www.sjq321.com/news/78761/ / / e.video-cdn.net/v2/embed.js " > 微ct XZ全景横切面通过一个花被片的假花药:一个雄蕊的前体。色阶表示细胞密度。 下载原文档:https://link.springer.com/content/pdf/10.1007/s00709-023-01846-6.pdf