非诺贝特(FEN)是一种抗脂药,可增加脂蛋白脂肪酶的活性,从而促进脂肪分解;然而,它可能引起肌病和横纹肌溶解在人。辅酶Q10 (CoQ10)是一种内源性合成的化合物,存在于大多数活细胞中,在细胞代谢中起重要作用。它在线粒体呼吸链中充当电子载体。本研究旨在阐明芬酮诱导的大鼠骨骼肌变化,并评估辅酶q10在预防或减轻这些变化中的功效。将40只成年雄性大鼠平均分为四组:阴性对照组给予生理盐水,阳性对照组给予辅酶q10, FEN治疗组给予FEN, FEN +辅酶q10组同时给予FEN和辅酶q10,每天服用4周。处死动物,取血测定肌酸激酶(CK)。取比目鱼肌标本进行光镜和电镜研究。本研究表明,FEN增加CK水平,诱导炎症细胞浸润和肌肉结构紊乱,并伴有条纹丢失。FEN增加了变性胶原纤维的百分比和caspase-3的免疫表达。超微结构上,FEN引起肌原纤维变性,细胞器扭曲。CoQ10的抗纤维化和抗凋亡作用可显著改善fen诱导的肌纤维结构变化,并在很大程度上恢复肌纤维的正常结构。综上所述,CoQ10通过抑制氧化应激、减轻炎症和抑制细胞凋亡来改善肌肉结构。
高脂血症是动脉粥样硬化的主要原因,动脉粥样硬化主要导致冠心病。改变生活方式被认为是治疗高脂血症的首选。然而,在不受控制的情况下,降脂药物有助于控制升高的血脂水平。他汀类药物主要降低胆固醇水平,而贝特类药物主要降低脂肪酸和甘油三酯(TG) (Tarantino et al. 2017;Kim et al. 2019)。
非诺贝特(FEN)是一种合成纤维酸衍生物,在肝脏中转化为其活性形式,非诺贝特酸。它是一种过氧化物酶体增殖物激活受体-α (PPAR-α)激动剂,可激活负责脂肪酸代谢的基因,如线粒体β-氧化(Sohn et al. 2017)。FEN增加脂蛋白脂肪酶的活性,从而促进脂肪分解,降低富含tg的脂蛋白水平,提高高密度脂蛋白(HDL)浓度水平,对心血管系统产生额外的保护作用(Emami et al. 2020)。尽管有这些有益的作用,FEN可能在大鼠和人身上引起肌病和横纹肌溶解(Okada et al. 2009;Wang and Wang 2018)。
辅酶Q10 (CoQ10)是一种内源性合成的苯醌类化合物,被广泛称为泛醌,存在于体内大多数活细胞中。它是动物细胞从头合成的唯一脂溶性抗氧化剂。它主要存在于线粒体中,并通过在线粒体呼吸链中作为电子载体的关键作用,作为ATP生成的辅助因子(Garrido-Maraver et al. 2014)。它也存在于细胞膜中,是维持细胞膜磷脂免于过氧化的抗氧化系统的主要分子,是细胞膜和所有胞内膜的膜稳定剂。此外,它还可以保护膜蛋白和脱氧核糖核酸(DNA)免受氧化损伤(Silva et al. 2022)。
在生物体中发现的辅酶q10的主要形式是还原活性形式,泛醇(CoQH2),它主要负责其抗氧化特性(onur et al. 2014)。辅酶q10在衰老相关疾病中具有治疗益处,主要是伴随氧化应激增加的疾病(Diaz-Casado等人,2019),并由于其抗炎、抗氧化和抗凋亡特性而减轻铅和砷的重金属毒性(al - megrin等人,2020;Silva et al. 2022)。
因此,本研究旨在阐明FEN给药后成年雄性白化大鼠骨骼肌的变化,并评价辅酶q10在预防或缓解这些变化中的作用。
非诺贝特(Lipanthyl?,300 mg/胶囊)购自Minapharm,获法国Laboratories Fournier许可。辅酶Q10(30毫克/明胶胶囊)购自阿拉伯制药和药用植物公司。
从曼苏拉实验研究中心(MERC)获得雄性大鼠40只(3 - 4月龄,180-200 g)。将大鼠置于20-22℃的空调实验室,光照/黑暗循环12 h。使用标准的商业颗粒饲料和随意取水。在实验开始前,让大鼠适应环境2周。实验方案经曼苏拉医学院机构研究委员会(IRB)批准(代码:MD/17.12.42)。实验是按照国际实验动物使用准则进行的。
适应期结束后,将大鼠随机分为4组:阴性对照组(10只大鼠),给予生理盐水;阳性对照(辅酶q10)组(10只大鼠),将辅酶q10粉末溶于2 ml 0.5%羧甲基纤维素(CMC)中,以100 mg/kg/天的剂量经胃管给予辅酶q10,持续4周(Haredy et al. 2017);FEN组(10只大鼠),每日1次,经胃管给药,剂量为60 mg/kg/天,溶解于2 ml 0.5% CMC中,连续4周(Pettersen et al. 2012);以及FEN + CoQ10组(10只大鼠),每天以与FEN组相似的剂量服用FEN,然后以与阳性对照组相似的剂量服用CoQ10。
实验结束时,动物腹腔注射戊巴比妥钠(40 mg/kg)麻醉(Kao et al. 2006)。
使用Sigma-Aldrich (St. Louis, MO, USA)的商用试剂盒(MAK116),从所有动物的尾静脉采集血液样本,以估计肌酸激酶(CK)作为肌病和肌肉破裂的生物标志物的血浆水平(Jansone等人,2016)。
处死大鼠,解剖各动物右后肢比目鱼肌一部分,置于低温恒温器中测定琥珀酸脱氢酶(SDH),以区分ⅰ型和ⅱ型纤维。1型纤维更容易受到纤维引起的肌肉毒性的影响,因此本研究选择了比目鱼肌,因为它主要由1型纤维组成(Okada et al. 2009)。其余肌肉标本置于10%中性缓冲福尔马林(NBF)中,制备免疫组织化学石蜡切片。然后向大鼠左心室灌注500 ml含有2.5%戊二醛和2%多聚甲醛的磷酸盐缓冲液(0.1 mol) (Monteiro et al. 2008)。获得各组动物左后肢比目鱼肌。将部分肌肉固定在10%的NBF中,处理后制备石蜡切片用于光镜观察。其他小肌肉标本(1 mm)置于2.5%戊二醛和2%多聚甲醛的混合物中,后置于1%四氧化锇中固定,处理后得到半薄切片(甲苯胺蓝染色)和超薄切片,用于电镜观察。
肌肉标本在10%的NBF中固定24 h,脱水、清洗、包埋制成石蜡块,切片得到5 μm厚的石蜡切片。切片用苏木精和伊红染色(H & E)进行常规组织学研究(Bancroft and Layton 2019b),用Mallory三色染色显示胶原纤维(Bancroft and Layton 2019a)。
将肌肉标本放入低温恒温器(- 15°C)中,切开10μm厚的新鲜冷冻切片,准备用于SDH组织化学研究(Highley and Sullivan 2019)。
另一组石蜡切片采用过氧化物酶标记链亲素生物素技术,用凋亡标志物caspase-3进行免疫组织化学染色(Sanderson et al. 2019)。切片在二甲苯中脱蜡,用酒精再水化。用3% H2O2孵育10分钟,阻断内源性过氧化物酶活性。载玻片在pH 7.4的磷酸盐缓冲盐水(PBS)中冲洗10分钟,然后将载玻片放入溶解在PBS中的牛血清白蛋白(1%)中,37°C,以减少非特异性背景染色。抗原提取通过在柠檬酸缓冲液(10 mmol/l)中加热切片实现。随后,单克隆抗caspase-3抗体(稀释为1:100;目录号:sc-65497, Santa Cruz Biotechnology, Santa Cruz, CA, USA)在4°C下过夜。然后用PBS洗涤切片,用合适的二抗(m-IgG2a BP-HRP, Santa Cruz Biotechnology, Santa Cruz, CA, USA)在室温下孵育1小时。这些抗体用二氨基联苯胺(DAB)显像,苏木精反染。阴性对照玻片除与一抗孵育外,采用相同步骤处理。扁桃体切片作为阳性对照。
将小肌肉标本置于含有2.5%戊二醛和2%多聚甲醛的0.1 mol/l钙酸钠缓冲液(pH 7.4)中。随后,将标本置于2%四氧化锇和0.1 mol/l钙酸钠缓冲液(pH 7.4)中,在4℃下固定1小时。组织碎片经过脱水和清理后,最终包埋在环氧树脂中。切片半薄(1 μm),甲苯胺蓝染色。超薄切片(60-70 nm)使用超微切片机切割,在铜网格上挑选,并用2%醋酸铀酰和柠檬酸铅染色。然后用JEM-100CXi (Jeol, Tokyo, Japan)在埃及亚历山大亚历山大大学理学院电子显微镜室对标本进行检查。
使用安装在Olympus?光学显微镜(CX31;日本)。使用Image J 1.52a (National institutes of health, USA)检测获得的照片,测量H & e染色切片中退行性肌纤维的百分比,Mallory三色染色切片中胶原纤维的百分比,免疫组织化学染色切片中caspase-3阳性纤维的百分比。每个染色对实验中每只动物的6张载玻片进行检查。随机选取6个不重叠的字段来估计统计数据。
使用SPSS version 26 (SPSS Inc., Chicago, Illinois, USA)分析生化和形态计量学数据。采用Kolmogorov-Smirnov检验检验数据正态性,数据呈正态分布。定量结果以均数±标准差表示,采用单因素方差检验(ANOVA)和Tukey事后检验进行分析。p值≤0.05认为有统计学意义。
摘要
介绍
材料与方法
结果
讨论
结论
参考文献
作者信息
道德声明
搜索
导航
#####
H和e染色切片
阳性对照组和阴性对照组的比目鱼肌切片结果相似。对照组比目鱼肌的纵切面(LS)显示了肌纤维的组织结构,肌肉的结构单位。它们长,有条纹,无分支,具有细长的,多个,周围的泡状核和亲酸的肌浆(图1a, b)。肌肉纤维的横切面(TS)呈多边形形状,周围的核和亲酸的肌浆。肌纤维被结缔组织围膜包围成束(图1c)。
图1
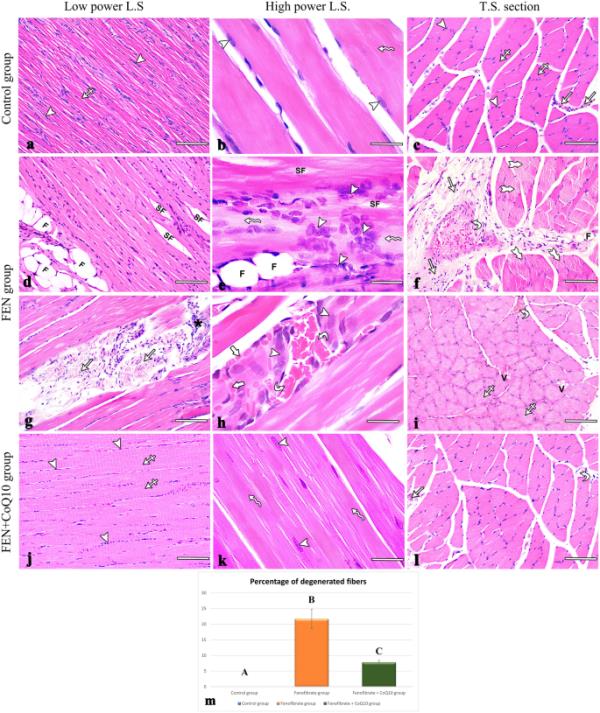
实验大鼠H & e染色比目鱼肌切片显微照片。(a - c)对照组(a, b) L.S.显示平行的无分支肌纤维,具有嗜酸细胞质(交叉箭头),规则的横向条纹(波浪箭头),周围有多个卵形核(箭头)。(c) T.S.显示多面体纤维束,周围有卵圆形核(箭头)和嗜酸细胞质(交叉箭头),由结缔组织围膜(箭头)隔开。(d-i) FEN组。(d, e)肌纤维(SF)分裂,中间夹着脂肪细胞(F),肌纤维组织紊乱,细胞核聚集(箭头),条纹缺失区域(波浪箭头)。(g, h)纤维间过量结缔组织(箭头)伴炎性细胞浸润(黑色星号),血管充血(曲线箭头),红细胞外渗(粗箭头)。(f, i) T.S.显示过多的结缔组织肌周膜(箭头),血管充血(曲线箭头)和脂肪细胞(f)。细胞质碎片化(分叉箭头),苍白(交叉箭头),空泡化(V)。(j - 1) FEN + CoQ10组。(j, k) L.S.显示平行的无分支肌纤维与嗜酸细胞质(交叉箭头),规则的横向条纹(波浪箭头)和多个外围卵形核(箭头)。(l) T.S.显示由结缔组织肌束膜(箭头)隔开的肌肉纤维束,其中含有血管(弯曲箭头)。(m)各组比目鱼肌退行性纤维百分比(平均值±SD)的统计分析。不同字母表示差异显著,p≤0.05。分:非诺贝特;辅酶Q10:辅酶Q10;l.s.:纵剖面;t.s.:横切面;红细胞:红细胞。(a, c, d, f, g, i, j, l)比例尺:100 μm, (b, e, h, k)比例尺:25 μm
FEN组的LS切片显示肌纤维结构扭曲,条纹缺失,部分肌纤维分裂,核集中移位。肌纤维间可见炎性细胞浸润、红细胞外渗、血管充血和大量脂肪细胞(图1d、e、g、h)。肌纤维TS切片含有苍白、空泡状的肌浆,周围是增厚的结缔组织,肌周围有充血的增厚的血管和一些脂肪细胞(图1f、i)。p < 0.001),与对照组相比(图1m)。
FEN + CoQ10组的LS和TS切片显示,与FEN组相比,大多数纤维的组织结构得到了显著的保存(图1j, k, l)。与FEN组相比,该组变性纤维的百分比显著降低(7.74±0.66,p<0.001)。但与对照组相比,有显著增加(p=0.008)(图1m)。
对照组半薄切片甲苯胺蓝染色显示肌肉纤维横纹规则,外周核拉长(图2a)。FEN组切片显示肌原纤维细胞核不规则移位,肌膜不规则。肌浆中有液泡、变性区和条纹丢失(图2b)。对FEN + CoQ10组的切片检查显示,肌肉纤维几乎正常,有规则的横向条纹和延长的外周核(图2c)。
图2
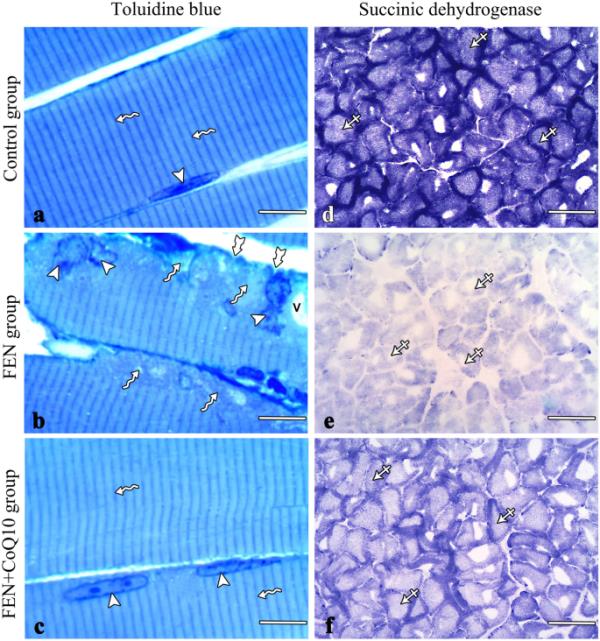
甲苯胺蓝(a-c)和SDH (d-f)染色的肌肉切片显微照片。(a)对照半薄切片显示规则的横纹肌原纤维(波浪形箭头)和细长的周围核(箭头)。(b) FEN组显示不规则的肌膜(双歧箭头),细胞核不规则移位(箭头),细胞质液泡(V),条纹缺失区域(波浪箭头)。(c) FEN + CoQ10组显示横纹肌原纤维(波浪形箭头),外周核(箭头)拉长。(d)对照组SDH染色强度高(交叉箭头)。(e) FEN组强度较弱(交叉箭头)。(f) FEN + CoQ10组呈中等强度(交叉箭头)。分:非诺贝特;辅酶Q10:辅酶Q10;SDH:琥珀脱氢酶。(a、b、c)标尺:10 μm, (d、e、f)标尺:100 μm
在对照组中,对冷冻的比目鱼肌TS进行组织化学研究,检测SDH活性,发现该肌肉主要由深度染色的纤维组成(I型)(图2e)。FEN组的切片显示,大多数纤维的染色反应较弱(图2f),而FEN + CoQ10组的切片显示,与FEN组相比,染色反应强度略有增加(图2g)。
在对照组中,马洛里三色染色的比目鱼肌TS切片显示肌纤维之间和血管周围有少量胶原纤维(图3a)。FEN组的切片显示肌纤维之间和血管周围有过量的胶原纤维(图3b)。实验组胶原纤维面积百分比(21.75±3.68,p < 0.001)明显高于对照组(4.42±0.98)(图3d)。另一方面,FEN + CoQ10组的切片显示肌肉纤维之间和血管周围有少量胶原纤维(图3c)。与FEN组相比,实验组胶原纤维面积百分比(9.14±1.84,p < 0.001)显著降低,与对照组相比显著升高(p=0.042)(图3d)。
图3
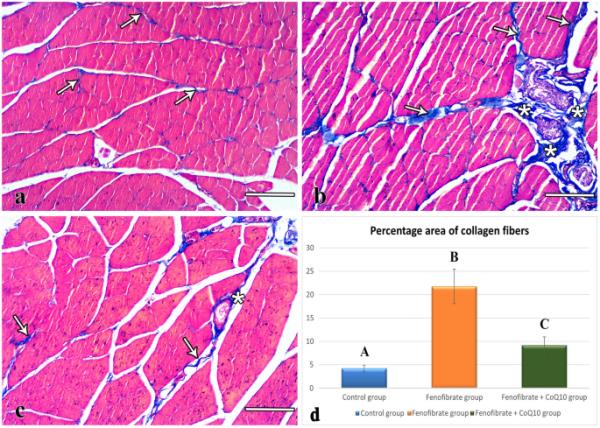
马洛里三色染色切片的显微照片。(a)对照肌纤维之间有少量胶原纤维(箭头)。(b) FEN组肌纤维之间(箭头)和血管周围(星号)胶原过多。(c) FEN + CoQ10肌纤维之间(箭头)和血管周围(星号)有少量胶原。(d)各组胶原纤维百分比面积统计分析(mean±SD)。不同字母表示差异显著,p≤0.05。分:非诺贝特;辅酶Q10:辅酶Q10(a、b、c)比例尺:100 μm
对照组的抗caspase-3染色切片检查显示,该标记物在肌纤维中免疫表达为阴性(图4a)。FEN组的切片显示部分纤维细胞质中caspase-3阳性免疫反应(图4b)。实验组caspase-3阳性纤维面积百分比(26.79±4.62,p < 0.001)明显高于对照组(2.06±0.29)(图4d)。FEN + CoQ10组的切片显示轻度阳性的细胞质免疫反应性(图4c)。与FEN组相比,caspase-3阳性纤维面积百分比(10.35±2.37,p < 0.001)极显著降低;但与对照组相比,有显著增加(p=0.005)(图4d)。
图4
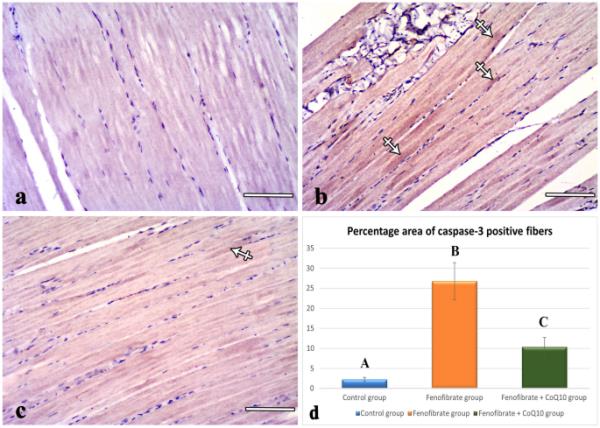
抗caspase-3免疫染色切片的显微照片。(a)对照肌纤维caspase-3免疫反应为阴性。(b) FEN组肌纤维细胞质(交叉箭头)阳性反应。(c) FEN + CoQ10肌纤维细胞质中轻度阳性反应(交叉箭头)。(d)各组caspase-3阳性纤维百分比面积的统计分析(mean±SD)。不同字母表示差异显著,p≤0.05。分:非诺贝特;辅酶Q10:辅酶Q10(a、b、c)比例尺:100 μm
对照组比目鱼肌超薄切片超微结构正常,肌原纤维填充肌质。它们平行于肌纤维的纵轴排列。它们显示出规律排列的交替亮(I)和暗(A)波段。在A波段的横切处观察到一个苍白狭窄的区域,即H波段。暗M线平分H带,而Z线平分I带。在两个连续的Z系之间检测到肌瘤。在Z线两侧肌原纤维之间可见线粒体。肌浆网在A-I交界处清晰可见。肌膜下可见细长的同色核(图5a, b)。骨骼肌的特征性三联体清晰可见,由一个T小管和两个肌浆网池组成(图5c)。
图5
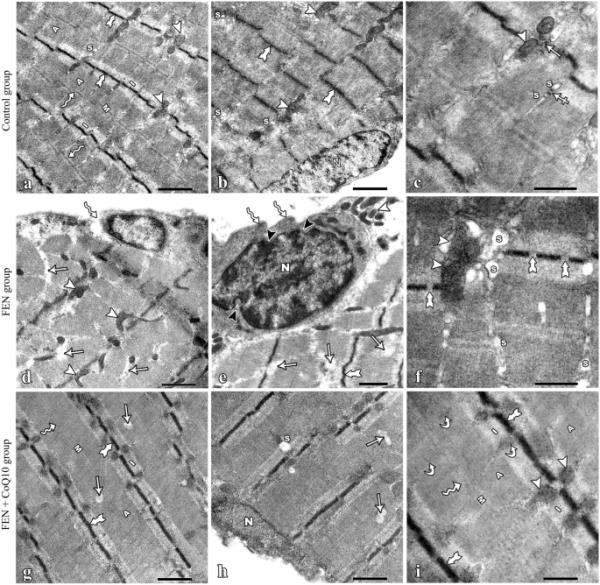
实验大鼠比目鱼肌的电子显微照片。(a, b)对照大鼠肌原纤维的正常带型,I带(I)和a带(a)交替出现。Z线(双歧箭头)出现在I带中间,H带(波浪箭头)被M线(M)一分为二,肌原纤维之间可见线粒体(箭头)。肌浆网(S)位于A-I交界处。细胞核(N)外周,卵圆形,常染。(c)骨骼肌特征性三联,由肌浆网的1个T小管(交叉箭头)和2个池(S)组成。此外,肌原纤维之间还有糖原颗粒(箭头)和线粒体(箭头)。(d、e)肌原纤维肌膜不规则、断裂(波状箭头),变性区(箭头),不规则Z线(双歧箭头),线粒体形状异常(箭头),细胞核形状不规则(N),核膜不规则(黑色箭头)。(f)肌原纤维肌浆网扩张(S),线粒体退化(箭头),Z线断裂(双歧箭头)。(g-i) FEN + CoQ10组肌原纤维保持正常带型,I带(I)和A带(A)交替出现,I带中间出现Z线(双歧箭头),H带中间出现M线(M)(波浪箭头)。线粒体(箭头)成对排列在Z线周围,可见一些糖原颗粒(曲线箭头)。细胞核(N)为外周卵圆形。可见少量变性灶(箭头)和扩张的肌浆网(S)。FEN:非诺贝特;辅酶Q10:辅酶Q10(a、b、d、e、g、h)比例尺:0.1 μm。(c, f, i)比例尺:500 nm
FEN组肌肉的超薄切片显示肌原纤维不规则,肌膜断裂。部分细胞核不规则,核包膜不规则。细胞质出现退行性变和Z线断裂。一些线粒体出现异常,变性,并在肌膜下成组(图5d, e)。肌浆网扩张(图5f)。
FEN + CoQ10组的比目鱼肌超薄切片检查显示肌原纤维结构明显改善。大部分肌原纤维形态接近正常,外周核呈卵圆形,I带和A带规则交替。Z线出现在I波段中间,M线出现在A波段中间。线粒体成对排列在Z线周围。但部分肌原纤维变性灶少,Z线断裂。一些肌原纤维的肌浆网扩张(图5,h, i)。
血清肌酸激酶水平
FEN组总CK水平(1416.47±210.62,p < 0.001)显著高于对照组(753.51±72.06),而FEN + CoQ10组总CK水平(987.54±125.73,p < 0.001)显著低于FEN组。然而,与对照组相比,FEN + CoQ10组显著增加(p=0.011)(图6)。
图6
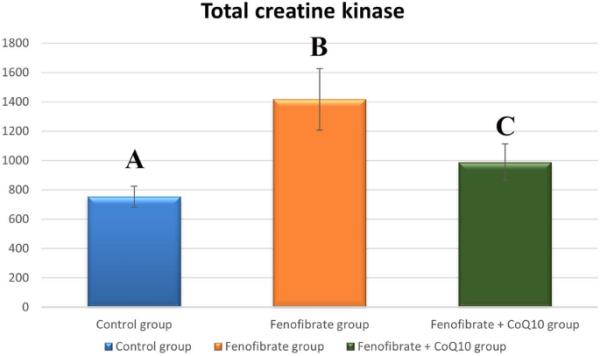
各研究组总CK水平(mean±SD)的统计分析。不同字母表示差异显著,p≤0.05
下载原文档:https://link.springer.com/content/pdf/10.1007/s00418-023-02205-5.pdf